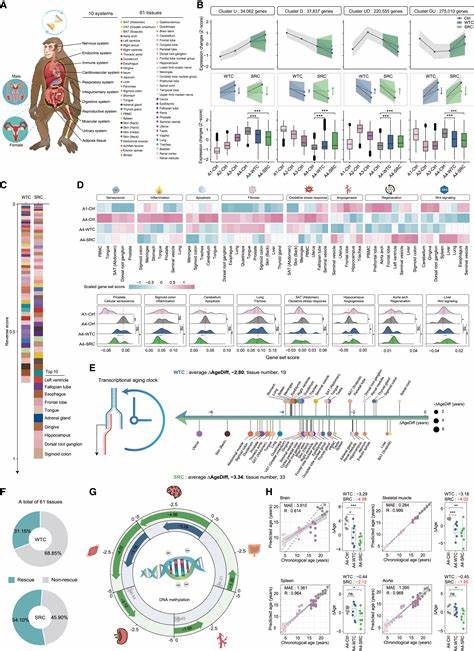
随着全球人口老龄化问题的日益突出,延缓衰老、提升老年人健康寿命已成为医学界和社会关注的焦点。衰老不仅表现为外貌的变化,更伴随着多组织、多系统的功能下降,尤其是干细胞功能的减退,成为导致机体老化的关键因素之一。近年来,间充质干细胞(Mesenchymal Stem Cells,MSCs)因其自我更新和多向分化潜能,成为再生医学和抗衰老领域的研究热点。特别是经过基因编辑和功能强化的抗衰老人源间充质干细胞(Senescence-Resistant Cells,SRCs)在灵长类动物中的应用,展现出显著的抗衰老效果,为人类对抗衰老开辟了新路。SRCs的研发背景与意义离不开对衰老机制的深入理解。衰老过程中,干细胞数量和功能逐渐下降,细胞凋亡增加,组织再生能力减弱,同时慢性低度炎症状态(俗称"炎症老化")持续存在,损伤修复和免疫系统效率下降。
传统抗衰老疗法多侧重于减缓这些症状,而SRCs则通过恢复和增强干细胞的功能,直接干预衰老源头。对SRCs的基础研究表明,通过基因编辑技术,如增强FOXO3等关键长寿基因的表达,能够提升间充质干细胞的抗氧化能力、DNA修复效能及应对压力的适应力,从而减缓或逆转细胞衰老过程。FOXO3基因被认为是调控机体寿命的核心因子,其在维持干细胞稳态、抵抗细胞应激方面发挥重要作用,使得靶向调控该基因成为SRCs设计的重要方向。最近一项针对年老猕猴的长达44周临床前试验,采用静脉注射方式输送经过基因强化的SRCs,效果令人振奋。研究团队发现,接受SRCs治疗的猕猴体内衰老指标显著下降,包括细胞衰老标记物减少、慢性炎症水平明显降低以及重要组织器官的退化速度明显减缓。尤其是在脑部结构和认知功能方面,SRCs的输入有效增强了脑内神经连结和功能活动,提升了记忆力和学习能力。
同时,猕猴的生殖系统功能明显改善,显示出生育能力的回升。这些数据首次在灵长类动物中证实了通过抗衰老干细胞治疗带来的多系统改善,体现了SRCs的广泛组织保护作用。SRCs发挥抗衰老作用的机制部分归功于其分泌的外泌体(Exosomes)。这些含有多种生物活性分子的纳米囊泡,能够穿越生物屏障,递送抗炎因子、抗氧化因子及调节基因表达的小RNA片段到受体细胞,从而重塑机体的细胞环境,抑制细胞衰老和炎症反应。外泌体作为无细胞治疗的代表,具有低免疫原性和丰富的功能组分,为未来的临床应用提供了巨大潜力。针对SRCs的研究还涉及对比普通间充质干细胞和基因强化后细胞的差异。
实验发现,普通间充质干细胞在长期体内存活与功能维持方面存在局限,且衰老相关基因表达逐渐增加,影响治疗效果。而SRCs则表现出更强的自我修复和抗衰老功能,提升了细胞的存活率和效能。该发现为提升干细胞治疗的长期疗效提供了科学依据。在研究的多层次分析中,科学家还利用单细胞转录组测序技术揭示了SRCs在靶组织中的细胞谱系变化和基因表达网络,明确了调控抗衰老的分子通路。这些精细的数据为优化SRCs的功能设计和精准治疗方案奠定了基础。同时,SRCs的应用并未显示出明显的副作用,表明其安全性在灵长类动物模型中得到了初步保障。
然而,进入人类临床前仍需进一步开展大规模、多中心的临床试验,评估其长期安全性和疗效。SRCs的未来不仅局限于抗衰老领域,在其他老年相关疾病中如认知障碍、肌肉萎缩、骨关节退行性病变等也显示出极大治疗潜力。结合精准基因编辑与外泌体治疗,科学家们期望打造个性化、无创、高效的抗衰老干预手段,显著提升患者晚年生活质量。此外,SRCs的研发促进了生物技术的进一步创新,激发了干细胞工程、基因编辑及纳米技术的交叉融合。随着科技的发展,运用人工智能辅助细胞基因调控、优化外泌体负载,实现更精准的细胞功能调节和效能提升,将成为下一步的重点方向。尽管SRCs的研究前景广阔,但仍面临诸多挑战。
首先,如何确保基因编辑的精准度和避免潜在脱靶效应,是保障临床安全的关键。其次,跨物种间的生物异质性对治疗效果的影响如何消除或降低,也需持续探讨。此外,SRCs的生产工艺标准化及规模化制备技术,关系到其可持续广泛应用,亟需研发符合GMP规范的高效流程。总体来看,抗衰老人源间充质干细胞代表了未来抗衰老医学的重大突破。其通过从细胞层面逆转衰老过程,提供了比传统药物更根本的治疗方案。随着科学研究的深入和技术的成熟,SRCs有望在不久的将来成为抗衰老及再生医学领域的重要基石,造福全球日益增长的老龄人口群。
面对人类健康寿命的挑战,SRCs为我们带来了希望,也激励科研者不断探索生命科学的新边界,为实现健康长寿谱写崭新篇章。 。