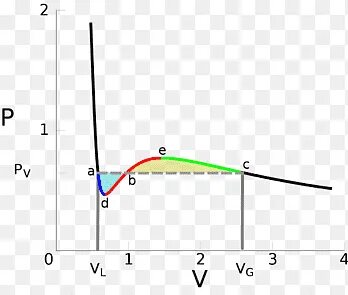
范德瓦尔斯方程:气体行为的转折点 在19世纪,科学家们对气体行为的理解逐渐深入,随着实验数据的增加,对于气体状态的描述也越来越复杂。约翰尼斯·迪德里克·范德瓦尔斯(Johannes Diderik van der Waals)于1873年提出了一种新型的气体状态方程——范德瓦尔斯方程。这一方程不仅是理想气体方程的扩展,也是现代热力学和物质科学的重要基石。 范德瓦尔斯方程的背景可以追溯到理想气体的模型。理想气体假设气体分子之间没有相互作用且分子自身体积可以忽略不计。然而,实际气体的行为并非如此简单。
热力学实验显示,气体分子不仅占有一定的体积,还会受到彼此间的吸引和排斥力作用。因此,范德瓦尔斯方程的提出,正是为了更准确地描述实际气体的行为。 范德瓦尔斯方程的基本形式为: (p + a(n/V)²)(V - bn) = nRT 其中,p为气体的压力,V为气体的体积,n为气体的物质的量,T为绝对温度,R为气体常数,而参数a和b则分别与气体的分子间相互作用和分子体积相关。 在这个方程中,参数a代表分子间吸引力的强度。具体而言,当气体被压缩或温度降低时,分子之间的吸引力会导致气体的压力低于理想气体的状态。这就解释了为什么在高压条件下,实际气体的压力往往低于理想气体的压力。
另一方面,参数b代表每摩尔气体分子占据的体积,反映了分子的体积效应。这意味着,实际气体所需的体积要大于理想气体的体积。 范德瓦尔斯方程的一大贡献是,它能够描述气体范德瓦尔斯循环,即气体在经历气化和液化过程中的行为。这在许多领域都具有重要意义,尤其是化学工程和材料科学。通过使用范德瓦尔斯方程,科学家和工程师可以更好地预测气体的行为,优化工业过程和设计新材料。 然而,范德瓦尔斯方程并不是完美的。
在高压或低温条件下,方程的预测往往与实验结果不符。同时,a和b这两个参数在不同气体中并不恒定,会受到温度和压力的影响。为了解决这些问题,许多更复杂的状态方程被提出,例如雷德利希–快克方程(Redlich-Kwong equation)和贝内迪克特-韦伯-鲁宾方程(Benedict-Webb-Rubin equation),这些方程在描述气体行为时能够提供更高的准确性。 在实际应用中,范德瓦尔斯方程帮助化学家和工程师理解气体的性质。例如,在新材料的开发过程中,了解材料在气相和液相之间的转变是至关重要的。范德瓦尔斯的理论也为超临界流体技术的发展奠定了基础,这种技术在许多领域,包括药物制剂和材料合成中,得到了广泛应用。
范德瓦尔斯方程也在教育领域留下了深远影响。它不仅是物理化学课程中的重要内容,也是学生理解气体行为的基础。通过学习这一方程,学生能够掌握气体状态与温度、压力和体积之间的复杂关系,为他们的科学探索打下坚实基础。 总结而言,范德瓦尔斯方程不仅仅是一个科学公式,它是一个连接理论与实践的桥梁,使得我们能够更好地理解和预测气体的行为。在科学发展的历程中,范德瓦尔斯的工作不仅展示了科学探索的复杂性,也体现了科学共同体不断追求知识的努力。随着科技的不断进步,范德瓦尔斯方程的内涵也将不断丰富,帮助我们在未知的领域继续探索。
。