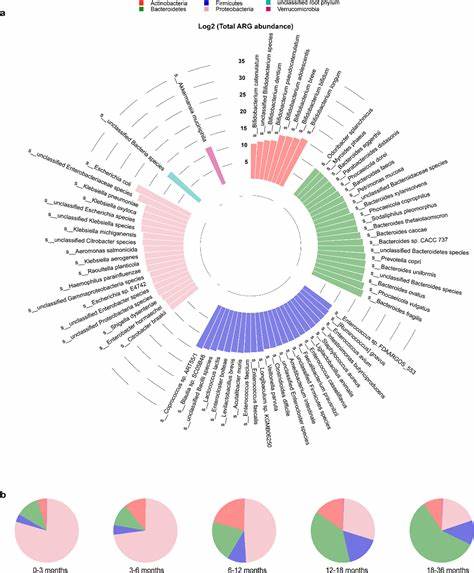
抗生素耐药性作为全球公共卫生的重大威胁之一,其出现与传播机制一直备受关注。新生儿时期,婴儿肠道微生物群的建立不仅对其免疫发育和健康具有深远影响,同时也是抗生素耐药基因积累和传播的重要窗口。近年来,研究者利用纵向定量宏基因组数据,深入揭示了婴儿早期肠道中抗生素耐药基因(ARGs)的动态变化以及关键微生物间相互作用,揭开了早期肠道耐药基因组形成的复杂机理。 从生命的第一周开始,婴儿肠道就检测到了大量的抗生素耐药基因,这一发现说明ARGs的初始来源或早期种子群可能来自母体或环境。研究显示,ARGs的绝对丰度及其丰富度在婴儿六个月时达到峰值,随后逐渐下降至接近成人水平。这一趋势提示肠道微生态和宿主因素在不同生长期对耐药基因组的塑造起着决定性作用。
值得注意的是,婴儿的出生方式对早期ARG动态具有显著影响。自然分娩的婴儿肠道中存在更高的ARG负荷,主要源于母体通过产道传递的肠杆菌科中的大肠杆菌菌株,这些菌株携带广泛的耐药基因库。相比之下,剖宫产婴儿的ARG数量较低,这或与初始菌群来源较少和环境暴露差异有关。 肠道内不同微生物之间的平衡关系对耐药基因的丰度产生重要影响。研究发现,大肠杆菌等ARG丰富的菌群数量与芳香族乳酸产量较高的双歧杆菌呈负相关。特定双歧杆菌种类通过其独特的芳香族乳酸脱氢酶(aldh)基因,能够将芳香族氨基酸转化为芳香乳酸类代谢产物,包括苯乳酸、4-羟基苯乳酸和吲哚乳酸。
这些代谢产物不仅在天然肠道环境中达到生理相关浓度,而且在体外实验中证明能够显著抑制大肠杆菌、克雷伯菌和柠檬酸杆菌等多种携带多种临床重要ARG的潜在条件致病菌的生长。此机制实现了肠道内ARG丰富菌群的自然抑制,有助于维持微生态稳定及降低耐药基因的扩散风险。 早期肠道中ARG的多样性和组成亦随时间发生深刻变化。研究中的样本数据指出,新生儿期ARG多样性表现出双峰分布,随后在六个月达到高峰,表现为种类丰富而且载量较大。此后,ARG多样性逐渐趋于稳定,至两岁时与成年水平相当。除此之外,出生场所亦影响ARG负荷,居家自然分娩婴儿肠道中ARG绝对丰度显著高于医院分娩的新生儿,提示环境微生物来源的不同及母体菌群传递效率的差异。
整体肠道菌群构成与耐药基因组的关联分析显示,大肠杆菌是ARG丰度的主要驱动菌种,具有极高的ARG携带能力和数量,且带有丰富的毒力基因。与此同时,多种双歧杆菌尤其是Bifidobacterium infantis和Bifidobacterium longum与ARG负荷呈负相关,即这些有益菌种通过代谢产物调控和竞争机制对肠道耐药性细菌产生抑制。母婴菌群的垂直传播研究更证实,自然分娩过程是特定大肠杆菌菌株传递的关键时期,母体菌群的健康状态直接影响初始肠道的ARG负荷。 对于抗生素的临床应用方面,早期接触抗生素并未在样本中显示持续增强的ARG负荷,提示肠道微生态可以在一个相对较短时间内部分恢复,且初始菌群的种类及丰度在耐药基因组构建中起更大作用。这一发现挑战了以往对抗生素使用后ARG持续增加的传统认知,呼吁更加重视早期环境与微生态调控在抗耐药预防中的价值。 在实际干预层面,促进肠道内芳香乳酸产能强的大肠杆菌抑制型双歧杆菌群体的定植及生长,如通过母乳喂养或益生菌补充,可能成为减少婴儿肠道ARG载量及阻断抗生素耐药传播的有效策略。
此外,利用芳香乳酸作为候选的天然抑菌因子,也为早期肠道微生态调节提供了新思路和潜在的药物研发方向。 研究同时强调了纵向连续取样在解析肠道ARG动态变化中的重要性。单一时间点的横截面分析难以揭示ARG丰度随年龄发展波动的真实趋势,易忽视关键转折期的复杂互动。长期追踪和多时点采样更清晰地展现了肠道耐药基因丰度与微生物群演替的时间相关性,并关联环境因素对微生态系统的影响。 随着精准医疗和个性化健康理念的发展,理解婴儿早期肠道微生态和耐药基因组的构建动态,能够指导临床实践中更合理的抗生素使用,减少不必要的暴露,降低耐药性风险。不断优化的宏基因组学与代谢组学工具为此类研究提供了强大技术支撑,也促成了微生物群落和代谢产物之间相关机制的深入解读。
未来的研究可进一步挖掘微生物代谢产物对抗生素耐药菌的抑制谱及机制,考察其在不同群体、不同地理环境下的普适性和变化。同时,评估生活方式、饮食等环境因素对ARG传播的影响,为全面预防抗生素耐药提供多维度策略。婴儿早期肠道菌群的健康培育与功能优化,将是遏制全球抗生素耐药蔓延的重要基石。 。