糖尿病,特别是1型糖尿病,是一种由于胰腺β细胞被自身免疫系统破坏,导致体内胰岛素分泌不足的慢性疾病。虽然现有胰岛素替代疗法能够在一定程度上控制血糖,但因其非生理性的精准管理及长期使用带来的并发症风险,真正的治愈方法仍未实现。细胞替代疗法,尤其是利用胰岛素分泌细胞的移植,因其天然响应血糖变化的能力,被认为是未来糖尿病治疗的热门方向。然而,临床推广受限于免疫排斥反应及细胞生存微环境等多重挑战,其中供氧不足成为最大制约因素之一。胰岛素分泌细胞对氧气的需求极高,正常胰岛内细胞依赖丰富的血液供应维持其活性。移植过程中,尤其是在非血管丰富的皮下组织,胰岛细胞经历严重缺氧,导致细胞死亡和功能障碍,影响治疗效果。
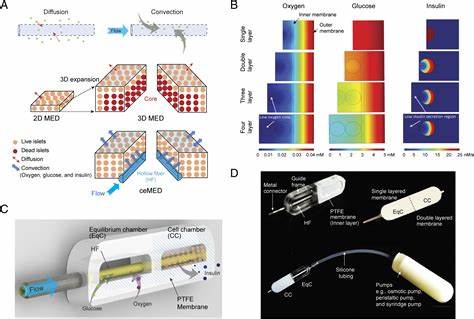
传统的微胶囊或宏胶囊封装技术通过半透膜阻挡免疫细胞入侵,避免免疫抑制剂的使用风险,提升了移植的安全性。然而,缺血阻碍了氧气和营养物质的扩散,限制了细胞载量和长期功能保持。近期,持续供氧的宏观封装系统(BioElectronics-Assisted Macroencapsulation,BEAM)引起了广泛关注,该系统通过植入式电化学氧气发生器,利用组织内水分进行电解,实现体内持续、可控的氧气生成,为胰岛素分泌细胞营造了一个更佳的存活环境。BEAM系统由两大核心部件组成:微型可植入的电化学氧气发生器(iEOG)和线性结构的细胞封装囊。氧气发生器利用膜电极组件技术,通过电解水产生氧气和氢气,两组气体分别从不同出口排出,氧气通过与细胞封装囊相连的气体通道输送,实现持续补氧。封装囊采用医用级聚醚嵌段酰胺(PEBAX)电纺纤维制备,配合海藻酸盐水凝胶浸渍,形成免疫保护的半透膜,既允许葡萄糖和胰岛素等分子自由交换,又能阻挡免疫细胞和大分子抗体入侵,兼顾生物相容性和功能需求。
该囊体设计为无边缘圆头的圆柱形,避免传统热封造成的硬边缘和机械刺激,减少术后纤维化反应,实现简便且低刺激的植入与取出。通过内外管套的同轴结构,细胞位于接近氧气管道的狭窄环形区,最大化氧气接触面,促进高密度细胞分布。iEOG在功率控制下,氧气产生可精准调节,覆盖从数千至数十万等效胰岛单位(IEQ)的多种负载需求。设计紧凑、重量轻,人体版尺寸约为13毫米直径、3.1毫米厚的圆盘,适合人体植入。系统在体外模拟及动物模型中均表现出稳定的氧气输出能力,实验持续时间最长达2.5年,有效支持600,000以上的IEQ,从根本上满足临床大规模细胞移植对氧气的需求。体外实验中,利用胰岛素瘤细胞和人源胰岛实验证明,该系统在严苛低氧环境(约1%氧含量)下显著提升细胞存活率及功能保持,细胞形态完整且胰岛素分泌恢复正常,优于无氧供给对照组。
进一步在全异体大鼠糖尿病模型中植入携带8000 IEQ的封装系统,并采用系统持续供氧。结果显示所有氧供组动物在3日内血糖恢复正常,而无氧组持续高血糖,表明系统有效逆转糖尿病状态,并维持至少3个月的疗效。血糖恢复期间动物体重显著增长,体内胰岛细胞组织也展现较好的存活及功能表现,未见免疫细胞渗透。系统还具有可调节供氧速率和可扩展设计,方便临床按照患者体重和细胞需求定制大小及容量。其线性结构和柔性材料确保植入时微创手术操作,减少组织创伤和不良反应,提升术后恢复质量。电化学供氧方式克服了传统使用化学氧源(如过氧化钙)的短期供氧限制,且无需频繁打气补充,提高了使用便利性。
未来,结合无线充电技术和智能传感反馈调节,有望实现全闭环自动化运行,进一步保障细胞长期稳定供氧,推动临床转化。尽管BEAM系统展示出令人鼓舞的前景,仍需解决包括氢气副产物的安全排放、设备体积进一步微型化以及长期植入的生物相容性等挑战。现阶段研究多数采用外置电子模块,动物啮齿类模型操作存在管线易损问题,亟待开发全植入式便捷方案,并在猪等大型动物中验证长期疗效与安全性。同时,精细调控供氧水平以避免氧气过剩形成气泡导致组织与囊体分离问题,需要纳入系统设计考量。综上所述,持续供氧宏观封装系统不仅突破了制约胰岛素分泌细胞密集封装的氧气瓶颈,还提升了移植细胞的生存环境和功能表现,降低了对免疫抑制剂的依赖。该技术代表细胞替代疗法向更实用、安全、长期的治疗模式迈出的关键一步,未来有望为全球百万1型糖尿病患者带来治愈的曙光。
随着生物电子学、材料科学与细胞疗法的深度融合,持续供氧宏观封装系统有潜力成为糖尿病细胞治疗的临床标准,为精准医学和个性化治疗打开新纪元。 。