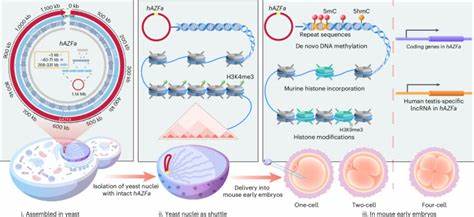
在现代生命科学领域,遗传学与合成生物学的交汇催生了前所未有的机遇和挑战。特别是在合成大规模基因组DNA和实现其在活体哺乳动物胚胎中的递送,研究者们取得了极大进展。近期,科学团队开发出一种名为SynNICE的创新方法,成功实现了合成百万碱基对(Mb)规模的人类DNA片段,并将其完整递送进小鼠早期胚胎,实现了对合成人类基因组DNA的去新(de novo)表观遗传调控的研究。此举不仅为大型人类基因组片段的合成组装和功能分析提供了强有力的技术支持,也拓宽了对哺乳动物发育中表观遗传修饰机制的理解和探索。合成基因组的构建与研究激发了对遗传信息编码和调控的深层解读。过去几年内,科学家们成功合成了细菌、酵母甚至致病病毒的整个基因组,为更复杂的哺乳动物基因组合成奠定了基础。
然而,由于哺乳动物基因组庞大且包含大量重复序列,百万碱基对级别的精准化学合成和组装尚属难题。现有技术主要集中于数十至百千碱基对范围的基因及其调控元素的合成,真正的染色体级功能重建仍然面临诸多阻碍。SynNICE技术突破了以往技术的限制,通过精细设计和化学合成,将人类Y染色体上的AZFa基因区整合至1.14 Mb的连续DNA构件中,并分步组装,确保高精度和高稳定性。AZFa区段因其与男性不育严重相关,且进化及功能特性独特,成为极具研究价值的目标。组装过程中采用了酵母的生物酶促 homologous recombination(同源重组)机制,将数百个5.5 kb合成短片段高效连接成大型构件,进而合并成整体1.14 Mb结构。值得注意的是,该区域富含高度重复序列,增加了组装难度,但新策略通过分阶段组合与CRISPR/Cas9辅助切割极大提升了效率与准确性。
组装完成后,酵母细胞不仅能稳定维护高重复度的超大DNA片段,而且通过转录组和蛋白质组分析表明,这些外源DNA对宿主酵母的生长及基因表达影响极小,同时未见人类基因的显著转录,显示异源表达极低。三维结构检测(Hi-C)展示该合成DNA在酵母核中以独立染色体的形式存在,形成特定的染色质相互作用。关键技术之一是NICE(Nucleus Isolation for Chromosomes Extraction),通过该方法从酵母中分离出完整的细胞核,保护合成大片段DNA的完整性及其原生的染色质结构。传统通过均质化和纯化过程往往导致酶降解而破坏染色质结构,此新方法创新性结合了DNase抑制剂、金属离子螯合剂以及多胺类化合物以维持染色体保持紧凑稳定的状态。一次纯化得到的核可被长期冷冻保存,保证了后续实验的持续性和重复性。NICE获取的酵母细胞核作为载体,实现了合成DNA稳定的物理封装,为后续递送至哺乳动物胚胎提供了坚实基础。
酵母细胞核被显微注射到小鼠成熟卵母细胞的细胞质内,避免了裸露大分子DNA在细胞融入过程中的断裂与降解问题。显著地,注射后,宿主小鼠胚胎能够自发将自身的组蛋白变体如H3.3和H2B置换包装合成的人类DNA染色质,表明宿主核质环境能够重塑外源DNA的染色体结构。这种组蛋白的替换对于恢复自然染色质状态及后续基因调控具有重要意义。此外,在卵母细胞和早期胚胎阶段,研究人员检测到合成DNA上快速建立了5-甲基胞嘧啶(5mC)DNA甲基化及其氧化产物5-羟甲基胞嘧啶(5hmC),证明了宿主细胞能够对完全未经过表观遗传修饰的合成DNA进行去新DNA甲基化修饰。DNA甲基化富集于合成DNA的重复序列区域,显示其非随机且特异性的定向修饰机制,区别于随机发生的过程。对照实验显示,注射非天然、人工设计的随机序列DNA时,宿主系统并未能有效启动DNA甲基化修饰,进一步支持了修饰的序列依赖性和功能选择性。
基因表达分析揭示,在合成DNA注入的小鼠早期胚胎中,关键基因如DDX3Y和UTY于四细胞期开始激活转录,其时间点与天然人类胚胎相符,且表达水平受DNA甲基化状态调节。抑制DNA甲基转移酶(DNMT)和Ten-eleven转化酶(TET)改变表达时序,证实DNA甲基化参与合成DNA的转录调控。该结果体现了宿主细胞利用天然的表观遗传调控机制,完成对“外来”合成染色体的功能整合和基因调控。此研究的重大意义不仅在于首次实现合成大型人类DNA片段在哺乳动物体内的递送和功能表达,更在于为探索发育早期表观遗传重编程机制提供了全新研究平台。通过由零开始的合成基因组构建,消除了天然基因组遗传背景和表观信息的干扰,能够清晰解析调控起始、行为及其时空动态。未来,基于此技术可以设计含多重功能模块、受控调节序列甚至疾病相关变异的合成染色体,结合胚胎发育模型,系统性揭示基因表达与表观遗传之间的因果关系,推动精准医疗及基因治疗的发展。
尽管目前合成DNA在细胞内复制效率有限,复制与遗传稳定性仍需优化,但SynNICE所展示的策略也为哺乳动物染色体级基因组合成、人工染色体开发提供了示范。展望未来,结合人工染色体载体系统,可实现更大规模DNA分子稳定传递与继承。此外,优化酵母DNA选择性失活策略减少外源染色体干扰,提升合成DNA生物学功能发挥。综合来看,基于酵母高效组装能力和细胞核递送优势,联合鼠胚胎发育模型,科学家得以实现百万碱基对规模合成人类DNA的生物学功能再现,为合成基因组技术和表观遗传研究开辟了新的方向,也促进了人类疾病机制解析与治疗策略创新。通过这项突破性工作,合成百万碱基对级人类DNA的精准组装与哺乳动物体内递送已成为现实,为解析复杂的人类基因组调控机制及未来大型基因组工程奠定了坚实基石。随着技术的不断进步与多学科交叉融合,未来借助该平台的研究将极大推动精准医学、发育生物学以及合成生物学的发展,助力人类健康与生命科学研究迈向新时代。
。