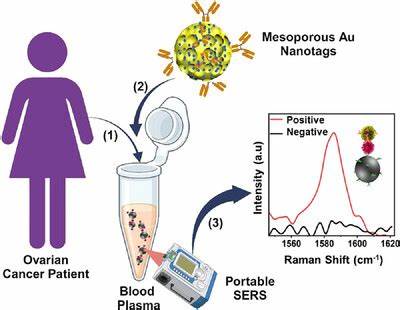
卵巢癌作为全球女性中致死率较高的恶性肿瘤之一,由于其早期症状隐匿,传统筛查手段常难以实现早期精准诊断,导致患者多在晚期才被发现,极大影响了治疗效果和生存率。近年来,胞外囊泡(Extracellular Vesicles, EVs)作为细胞间信息传递的重要介质,因其携带丰富的蛋白质、核酸及脂质等生物活性分子成为癌症早期诊断的潜在生物标志物。特别是在卵巢癌中,来源于肿瘤细胞的EVs在血液及多种体液中广泛存在,为非侵入式诊断带来了新的可能。传统EV检测技术如纳米颗粒追踪分析、流式细胞术等虽有一定成效,但依然面临灵敏度不足、操作复杂及时间成本高等问题,亟需创新方法加以突破。表面增强拉曼散射(Surface-Enhanced Raman Spectroscopy, SERS)技术因其对分子振动信号的极大放大能力和高度的化学特异性,被广泛视为实现超低浓度生物标志物检测的理想工具。黄金作为一种生物兼容性好且具有优良光学性能的贵金属,已被普遍应用于SERS基底制备中。
在众多纳米形态中,介孔金纳米颗粒凭借其高度的比表面积和丰富的孔隙结构,能在纳米尺度上形成大量的局域电磁热点,显著提升SERS信号强度。通过纳米工程设计,这些介孔结构不仅提升了抗体和探针的加载效率,也优化了光学响应,使得检测灵敏度得到质的飞跃。最新研究中,科学家们采用软模板法合成尺寸均一、孔径约20纳米的介孔金纳米颗粒,表面修饰了定位特异性胞外囊泡标志物的抗体,实现了PLAP(胎盘碱性磷酸酶)阳性的卵巢癌特异性胞外囊泡的快速捕获与超敏检测。PLAP是一种传统上与妊娠相关的酶类,近年来被发现于部分卵巢癌中呈异常高表达,成为区别卵巢癌与良性及健康样本的有效生物标记。结合介孔金纳米颗粒的SERS技术能够检测到生物样本中低至每毫升百个胞外囊泡的浓度,极大地超越了传统检测灵敏度,展示出极佳的临床应用潜力。此外,该方法基于磁性珠捕获与介孔金SERS探针的免疫夹心结构,整个过程简便,能够在常规实验设备甚至手持便携式拉曼光谱仪上完成,提高了检测的快速性与现场适用性。
临床验证显示,采用该系统检测卵巢癌患者的血浆样本,灵敏度与特异性分别达90%和85%,明显优于传统癌症标志物CA-125,为早期诊断及区分良恶性病变提供了强有力的技术支持。介孔金纳米颗粒的成功制备及其等离激元性能的优化是实现高性能SERS检测的基础。采用聚苯乙烯-聚乙烯氧化物嵌段共聚物作为模板,调控反应条件促使金离子均匀还原形成多孔结构,不仅保持了纳米颗粒的均一性,也有效突破了晶体结构中缺陷的限制。高分辨率透射电镜及扫描电镜表明,纳米颗粒保证了约200纳米的整体尺寸及规则的孔径分布,确保了优异的光学性能和生物分子结合效率。等离激元诱导的局域电磁场增强效应通过孔洞及粗糙表面形成的"热点"实现,极大提高了拉曼信号采集的效率,保障了生物分子低浓度检测的可行性。该技术平台不仅适用于PLAP这一单一标志物,还具备扩展性,能够整合多种肿瘤相关蛋白或核酸探针,实现多参数联合检测,进一步提升特异性和准确性。
尽管PLAP在卵巢癌诊断中表现出良好潜力,但其并非唯一标志物,结合CA-125等传统指标的多维模型可实现更全面的诊断覆盖。临床样本中,介孔金基SERS生物传感系统表现出快速、准确及高度重复性等优势,操作流程中仅需简单的混合孵育和磁分离步骤,降低了对高端设备和专业技术人员的依赖。样本检测时间控制在数小时内,适合临床日常诊断与动态监测。此外,平台所用耗材成本相对较低,易于推广应用。未来,结合大数据分析和机器学习算法,整合更多维度的EV特征数据,有望实现个性化精准医疗。随着研究的深入,介孔金基等离激元SERS检测技术预计将在卵巢癌早筛、病程监控及疗效评估等方面发挥更大作用。
患者样本的大规模临床验证和多中心合作将推动该技术逐步转化为临床标准检测手段。总之,基于介孔金纳米颗粒的SERS生物传感器为卵巢癌胞外囊泡的敏感特异检测开辟了新路径,不仅解决了当前检测灵敏度不足和操作复杂等难题,还具备便携性和成本优势,为未来无创癌症诊断带来了广阔的应用前景。集成先进的纳米材料设计与现代生物检测方法,将加速推动癌症早诊技术的变革,显著提升患者生存率和生活质量,造福广泛人群。 。