钾(符号K,原子序数19)是一种极具重要性的化学元素,属于碱金属族,拥有银白色的外观和极高的化学活性。钾元素首次由英国化学家汉弗莱·戴维于1807年从碱性物质中通过电解法成功分离出来,成为最早通过电解获得的金属之一。钾的名称来源于阿拉伯语"al qalīy",意指烧碱或草碱,其拉丁名称"kalium"也由此演变而成。钾呈现出一系列独特的物理与化学性质,在自然界中广泛分布,在工业及生命体内扮演着不可或缺的角色。 钾的原子结构决定了其极强的电正性和活泼的化学反应特性。这种金属质地柔软,可以用刀切割,切割后的鲜亮金属面会迅速氧化变暗。
钾在空气中极易与氧结合产生氧化物,也会与水剧烈反应,释放出氢气并形成氢氧化钾。其与水的反应热足以点燃生成的氢气,显示了其高度活跃的金属性质。钾的熔点约为63摄氏度,沸点约为759摄氏度,密度较低,约为0.89克每立方厘米。 钾元素广泛存在于自然界中,特别是在海水和多种矿物质中以离子形式存在。钾在地壳中的含量约占2.4%,位居第七位,但因其极强的活泼性通常以化合物形式存在,难以以纯态提取。主要的钾矿包括钾长石和盐类矿物,如明矾盐、钾镁盐、钾盐等,这些矿物主要形成于古代湖泊和海洋的沉积物中。
加拿大萨斯喀彻温省、美国加利福尼亚州、德国以及美国新墨西哥和犹他州等地拥有丰富的钾矿资源。钾的工业制备主要通过电解法处理氢氧化钾或高温下将氯化钾还原分离。 在工业方面,钾及其化合物具有重要用途。氢氧化钾作为强碱,在化学合成中扮演重要角色。钾盐如硝酸钾是火药的主要组成部分,广泛应用于军事和爆破工程。钾碳酸盐(俗称钾灰)被用于制造玻璃,能够提高玻璃的强度与耐久性。
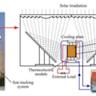
此外,钾蒸气用于磁力计和精密仪器,钠钾合金(NaK)具备良好的热传导性能,应用于高温冷却剂和干燥剂领域。钾的某些盐类还用于食品添加剂、防腐剂、药物以及农业肥料,促进植物的生长与健康。钾元素还在照相胶片、火工品、染料和陶瓷制造中发挥着技术支撑作用。 钾在生物系统中扮演极为关键的角色。作为细胞内主要的正离子,钾离子负责调节细胞内外的电解质平衡,维持神经信号传递和肌肉收缩等生理功能。钾离子的异常水平可能引发多种健康问题,血钾过低称为低钾血症,表现为肌肉无力、心律不齐甚至呼吸困难;而钾过高则称为高钾血症,也具有危及生命的风险。
因此,人体对钾的摄入和代谢处于精细平衡状态。日常饮食中富含钾的食物包括绿叶蔬菜如甘蓝、花椰菜,水果如橙子、香蕉、无花果,坚果、乳制品以及部分海产品。合理均衡摄入钾不仅有助于维持血压稳定,还有助于减少心血管疾病的发病率。 钾的测定对于化学分析和医学诊断都非常重要。实验室通常通过火焰光度计、原子吸收光谱仪、离子选择电极或等离子体发射光谱等先进技术对钾含量进行精确测量。此外,某些特定的试剂能够实现钾离子的分离鉴定,保证分析的准确性。
钾化合物在环境监测、农业研究及医疗检测等多个领域都有不可替代的地位。 关于安全防护,钾的高活性使其必须在严格控制的条件下存储和使用。通常储存在矿物油或煤油等惰性介质中,防止与空气及湿气接触以避免氧化和爆炸风险。仓储时间过长还可能在金属表面形成爆炸性过氧化物,打开容器时需格外小心。实验过程中应佩戴防护手套和护目镜,避免钾与皮肤和眼睛直接接触。遇火灾时,不能用水扑灭钾火,应采取干粉灭火剂与砂土覆盖等特殊方法。
钾的历史沿革和应用进步与现代科学技术的发展紧密相连。火药的发明提升了钾盐的重要性,电解分离技术推动了稀有金属的工业利用。钾不仅是化学工业的基石,还深刻影响着农业、医药和环境科学。通过深入理解钾的物理化学性质及其生物学功能,科研人员能够发展更多高效、安全的钾基材料和制剂,推动相关行业的创新和进步。 总之,钾元素是一种兼具科学研究价值和实际应用广泛性的关键材料。其在自然界的丰富储量与人体健康的紧密关联,使得钾不仅仅是实验室中的研究对象,更是现代生活中不可或缺的矿物资源。
随着科技的进步,对钾的探索和利用将更加深入,促进环境保护、农业增产和医疗健康等领域的持续发展。未来钾在新材料开发和可持续发展战略中的潜力也值得高度关注,充分体现其作为化学元素的核心地位和多重作用。 。