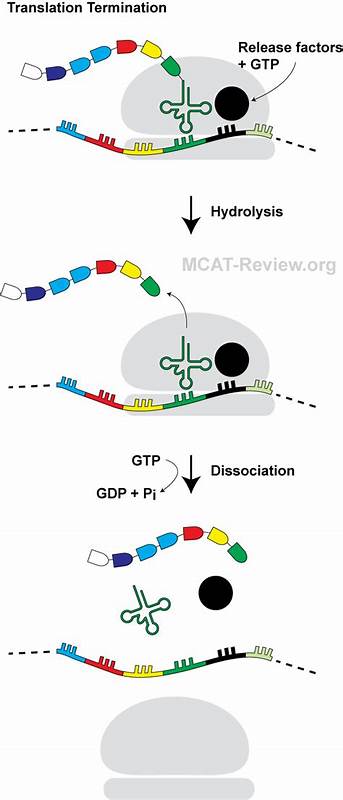
蛋白质合成是细胞生命活动的核心过程,确保遗传信息能够有效转录和翻译成具有生物功能的多肽链。然而,近年来研究证明,蛋白质合成不仅仅是一个简单的编码复制过程,其间涉及的调控机制远比想象中复杂。新发现的小型肽链——微型发卡肽,正是揭示这种复杂性的关键分子之一。微型发卡肽通过形成独特的空间构象,能有效阻断翻译过程中的终止阶段,改变了传统对翻译终止机制的理解。翻译终止本质上是基于核糖体识别mRNA上的终止密码子并由释放因子介导催化蛋白链从tRNA释放的过程,是蛋白合成周期的最后一步。通常情况下,释放因子RF2通过其含有的保存性GGQ三肽基序进入肽酰转移酶中心(PTC),引发多肽链释放。
但微型发卡肽的存在,却造成了这种释放因子的功能障碍,阻止了正常的翻译终止。研究显示,微型发卡肽由14个氨基酸残基组成,其肽链在核糖体出口通道内折回形成一个紧密的迷你发卡结构。与一般肽链朝向出口相反,微型发卡肽的N端朝向隧道入口,这种反向折叠在核糖体出口通道中营造出一种前所未有的空间结构。该“迷你发卡”结构不仅由肽链内残基间的疏水性相互作用和β折叠构象稳定,还通过与23S rRNA中的关键核苷酸形成多种疏水性结合,稳固地嵌入核糖体隧道之中。此特殊构象导致肽链C端的关键残基如异亮氨酸形成结构扭曲,直接占据释放因子GGQ肽基序应进入的活性口袋,从而产生空间冲突。释放因子的催化结构因这一冲突被推离原位,释放反应被阻断,蛋白质翻译被迫停滞于终止密码子之前。
这种机制显著不同于传统的翻译阻断模式,后者往往依赖环境信号分子作为“诱导剂”,通过与新生肽链或核糖体的结合引发结构改变,实现翻译暂停。而微型发卡肽则无需任何外部诱导剂,其自身氨基酸序列即可实现此翻译终止阻断,彰显高度的自我调节能力。有趣的是,该肽的翻译终止阻断还能被特定的分子机制“解除”。具体而言,带有色氨酸的tRNA(Trp-tRNATrp)在存在充足色氨酸的环境下,能够识别UGA终止密码子并进行密码子“读穿”,促进翻译持续进行而绕过阻断位点。此现象说明微型发卡肽不仅以特异结构阻碍释放因子功能,还通过调控停止密码子的解读方式,实现对翻译终止的细致控制。这种“读穿”机制也为细菌细胞根据氨基酸代谢状态灵活调整蛋白合成提供了分子基础。
为了揭示微型发卡肽介导的终止阻断详细结构,研究团队利用冷冻电子显微镜技术对停滞核糖体进行了高分辨率结构解析。解析结果展示了肽链折回的发卡形态,以及核糖体内释放因子的构象重排。这不仅证实了迷你发卡结构对释放因子GGQ肽基序的阻断作用,也揭示了有关23S rRNA关键核苷酸的构象变迁,加深了对核糖体翻译调控的理解。更进一步的功能验证表明,替换或突变肽链中的关键残基如异亮氨酸,会导致翻译阻断现象消失,细菌生长不受影响。这表明肽链特定的氨基酸序列和空间结构对翻译终止控制具有决定性作用,且相关序列在进化上可能经过精密调节以适应环境需求。微型发卡肽的发现不仅丰富了已知的核糖体介导翻译停滞(ribosome arrest peptide,RAP)家族,也为研究细菌如何通过氨基酸合成与蛋白质生物合成的协调提供了新线索。
传统视角认为,RAPs主要依赖代谢产物作为“开关”引导翻译停滞,而微型发卡肽则代表了一种基于肽链自身结构形成时间窗的调节策略。其独特的折叠与读穿机制可视为细菌对细胞内色氨酸供应动态调控的一种应答手段,帮助协调氨基酸代谢与蛋白质合成需求。此外,该肽的表达还能负调控其下游基因pepN的翻译,pepN编码一种氨肽酶,参与肽和蛋白质的降解,进一步显示其在细胞代谢网络中的多层次调控作用。相比于已有的感应型RAPs,如TnaC,微型发卡肽无需外部信号分子即可直接形成阻断结构,使得翻译控制更加简洁高效,避免了复杂的信号转导过程,在应对快速环境变化时或许具有优势。值得注意的是,尽管在标准实验条件下pepNL及相关sORFs展现了翻译阻断功能,其他小开放阅读框(sORFs)中仍存在未被充分挖掘的多样RAP潜能。这提示未来通过多技术结合,如蛋白质组学、核糖体测序及高分辨成像,有望揭示更加丰富的翻译调控肽类,揭开蛋白质合成调节的更多秘密。
微型发卡肽的研究不仅推动基础分子生物学的发展,也对抗菌药物设计、合成生物学与遗传工程等应用领域产生潜在影响。通过深入理解其分子机制,有望设计出针对翻译终止的新型抑制剂,实现精确的细菌生长控制。同时,微型发卡肽的折叠特征与调控模式也为人工设计可控翻译工具提供了灵感,可在生物制造和基因表达调节中发挥作用。总而言之,微型发卡肽作为一种独特的核糖体停滞因子,在阻断翻译终止方面发挥重要作用。其通过创新的肽链折叠方式和空间构象,阻碍释放因子功效,实现了无需外部诱导的大分子调控平台。色氨酸运用读穿机制进一步赋予调控柔性,使得蛋白质合成进程能够精准响应细胞环境变化。
这一发现不仅彰显了肽链在基因表达中的隐藏潜能,也开拓了分子生物学对细菌翻译调控的认识视野。未来跟随这一方向的深入研究,有望解密更多基于核糖体与肽链相互作用的翻译调控机制,推动生命科学及生物技术的持续前进。