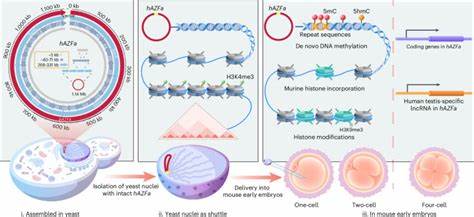
近年来,基因组合成技术的飞速发展为生命科学研究带来了革命性的突破。尤其是在哺乳动物层面,实现大规模、连续的基因组区域合成及功能验证成为科学家们的迫切目标。传统的基因合成及基因组改写多聚焦于较小基因区段,限制了对多基因调控网络和复杂基因组结构功能的全面探索。最新的研究突破了这一瓶颈,成功合成并组装了跨越百万碱基级别的完整人类DNA序列,并将其直接导入到早期小鼠胚胎中,为人类基因组功能的跨物种研究提供了全新平台。打造这样规模庞大且高度重复的DNA片段,本身就存在极高的技术挑战。人类基因组中含有丰富的重复序列和复杂调控元件,使得在微生物宿主如酵母菌中的稳定组装和维护尤为困难。
科研团队通过创新性的组合组装策略,将庞大的DNA序列切分为数百个小片段,再利用酵母的高效同源重组能力,分阶段、递进地精准组装成百万碱基规模的连续DNA链。这种方法不仅有效降低了组装过程中的错误率,还极大地提升了重复序列装配的成功率。值得强调的是,他们选择的基因组区域位于人类Y染色体的AZFa区段,该区域与男性不育相关,具有高度重复的内源性逆转录病毒序列,并且在进化中相对新近出现,避免了与小鼠基因组的同源干扰及剂量效应,从而极大提升了跨物种转移的实验可行性。为了克服将庞大合成DNA导入哺乳动物细胞的难题,研究团队提出了创新的“同步核隔离与细胞注射”技术(SynNICE)。该技术巧妙地利用酵母细胞自身的细胞核作为DNA载体保护结构,在保持DNA完整性的同时,有效避免了裸露DNA分子在提取、纯化和转染过程中的断裂和修饰问题。通过精准分离保存完整染色体结构的酵母细胞核,结合显微注射技术,团队成功将这些携带合成DNA的核结构直接送入了小鼠成熟卵母细胞。
注射后,跨物种的基因组进行了一系列快速而复杂的染色质结构重塑过程。小鼠早期胚胎内源性组蛋白迅速取代了酵母组蛋白,显示了高度保守且灵活的核小体重建机制。紧接着,研究人员利用敏感且高分辨率的测序技术,揭示了从零起始的DNA甲基化过程在外源合成人类DNA上的具体分布偏好。实验结果表明,去新生的DNA甲基化倾向于集中在重复序列区域,而并非随机发生,这与自然胚胎发育期间甲基化在重复元件上的动态调控相呼应。此外,与H3K9me3等常规沉默性组蛋白修饰并不完全同步,这暗示了非经典机制介导的表观遗传重塑。基于时间序列的转录组分析进一步揭示合成人类AZFa区段的基因表达在小鼠胚胎中的时序特征。
关键基因如DDX3Y和非编码RNA TTTY15在小鼠四细胞阶段被激活,表达模式与人类早期胚胎自然表达相似,却也受到了小鼠细胞环境的调控影响。通过抑制DNA甲基转移酶和Tet家族氧化酶的功能,实验验证了DNA甲基化和去甲基化动态在调控合成DNA区域基因启动中的核心作用。此项前沿研究不仅为跨物种人类基因组片段的合成与运行机制的揭示提供了技术范式,还为人类复杂疾病模型的构建、基因功能重组及表观遗传调控网络的解析带来了巨大潜力。基于百万碱基以上规模人类DNA的合成与功能表达,未来有望实现人工合成人类染色体甚至全基因组改写,助力精准医疗、再生医学及生物制造领域的创新。该研究同时开拓了合成基因组学与发育生物学的交叉新领域,以去新生合成DNA为切入点深度反思基因表达调控、染色质组装与环境适应性的基本生物学问题。随着技术水平的进一步提升,期望未来能实现合成基因组在更多哺乳动物系统中的跨界应用,以及合成基因组与外界环境和生物体内内源因子的复杂交互作用的解密。
此外,该研究带来的革新方法,将促进基因组编辑效率的极大跃升,为基因治疗策略精准递送超大规模基因载体奠定了技术基础。总之,通过百万碱基级人类DNA的化学合成、精准组装及同步核隔离注射至小鼠胚胎,科学家们开创了前所未有的跨物种基因组功能研究新篇章。利用小鼠早期胚胎作为活体平台,揭示了人类基因组片段的去新生表观遗传状态建立及精准基因表达调控规律,丰富并深化了对早期胚胎发育和基因组动态调控的理论认识。未来,SynNICE方法与合成基因组技术的结合有望推动合成生物学在哺乳动物研究及临床转化中迈上新台阶,为重大人类健康问题的解决提供重要科技支撑。