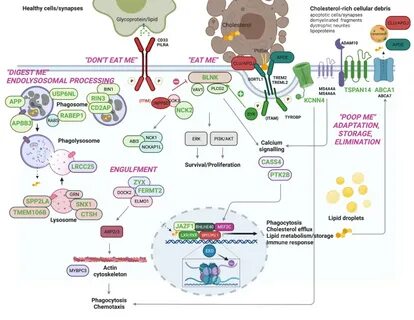
阿尔茨海默病作为全球最常见的神经退行性疾病之一,严重影响患者的记忆力、认知功能及日常生活能力,给患者家庭和社会带来了巨大负担。近年来,科学界对阿尔茨海默病的遗传基础展开了深入研究,发现许多与疾病进展高度相关的基因变异,其中罕见基因变异ABCA7引起了广泛关注。由麻省理工学院神经科学团队开展的一项创新研究,揭示了这一罕见基因变异如何通过扰乱脂质代谢和细胞膜功能,促使神经元进入应激状态,并最终促进阿尔茨海默病的发生发展。研究团队发现,ABCA7基因编码的蛋白质主要负责细胞膜脂质的运输与平衡。脂质作为细胞膜的重要组成部分,对维持神经元膜的流动性和功能具备决定性意义。携带ABCA7基因变异的人群中,该蛋白表达水平显著下降,导致神经元脂质代谢紊乱,细胞膜刚性增加,从而影响线粒体膜的正常功能。
线粒体作为细胞能量的中枢,其功能障碍引发的氧化应激反应是神经退行性疾病中的关键环节。进一步的单细胞RNA测序分析显示,ABCA7变异神经元中与脂质代谢、DNA损伤及氧化磷酸化过程相关的基因表达出现显著变化。尤其是线粒体中的 ''安全阀'' 活性降低,导致细胞内电荷过度积累和自由基产生,诱发氧化应激状态。这种细胞层面的损伤为阿尔茨海默病典型的病理特征提供了基础。最具突破性的是,研究者们通过对携带ABCA7变异的神经元进行CDP-胆碱处理,成功恢复了磷脂酰胆碱的合成,这一关键分子的补充修复了线粒体膜的电位平衡,显著降低了氧化压力。此外,神经元的过度兴奋现象和异常积累的β-淀粉样蛋白也得到了抑制。
这些结果不仅揭示了病理机制,更指明了潜在的干预路径。科学家利用源自诱导多能干细胞的三维神经类器官模型,验证了这些生物化学和生理现象在一个更接近真实脑组织环境中的一致表现。类器官中高水平的β-淀粉样蛋白积累被CDP-胆碱处理有效逆转,进一步证实胆碱代谢在调控阿尔茨海默病进程中的关键作用。值得注意的是,除了罕见的ABCA7变异以外,科学家还识别出一种更为常见且之前被认为无害的基因型也表现出类似的脂质代谢异常。这暗示着ABCA7相关的脂质代谢障碍可能在更广泛的人群中发挥潜在作用,提示今后临床检测和预防策略应更加重视这一基因的整体影响。这项研究延续了该实验室在APOE4基因变异研究中的成功经验。
APOE4同样通过干扰脑细胞脂质代谢,增加阿尔茨海默病风险。通过比较研究发现,调节脂质稳态的策略,特别是胆碱补充,既能缓解APOE4相关的神经病理,也能逆转ABCA7变异引发的细胞缺陷。大量流行病学研究显示,丰富的胆碱摄入来源包括蛋类、鱼肉、豆类和坚果,增加日常饮食中的胆碱或使用补充剂,具有天然的预防潜力。研究负责人李慧韶教授正在联合多家机构开展临床试验,评估胆碱补充剂对携带APOE4及ABCA7变异个体的认知保护效果,期待为公众健康提供新的可行方案。此外,研究还表明,细胞核遗传物质的损伤和修复不平衡,以及能量代谢的严重影响,共同作用于神经元的功能衰退和病理进展。这一多维度的病理网络为未来设计多靶点干预策略提供了理论依据。
综上,罕见ABCA7基因变异通过影响神经元脂质代谢和线粒体功能,破坏细胞膜及能量稳态,最终促进阿尔茨海默病典型病理的形成和发展。胆碱作为脂质代谢的重要前体,其补充能够有效逆转许多病理变化,具有显著的临床应用前景。随着研究的深入,这一发现不仅丰富了我们对阿尔茨海默病遗传机制的理解,也开拓了基于营养调节和基因功能恢复的新型治疗思路。未来的研究将聚焦于拓展受益人群、优化剂量方案及结合其他治疗手段,力图为阿尔茨海默病的预防和治疗带来实质性突破。 。