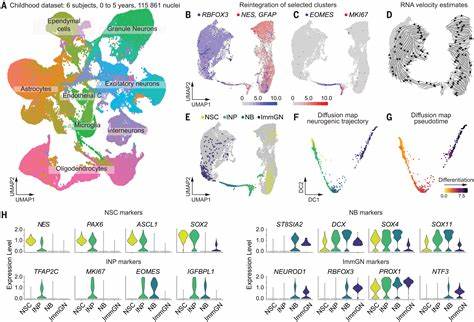
神经发生,尤其是成人大脑神经发生,是神经科学领域长期以来备受关注且广泛争议的话题。在哺乳动物大脑中,海马体作为关键的学习记忆和情绪调控中枢,长期以来被认为是新神经元生成的重要场所。但在人类中,成年期是否存在持续的神经前体细胞增殖以及新神经元生成,一直处于激烈讨论之中。最新的研究突破了这一领域的瓶颈,借助尖端的单核RNA测序技术结合机器学习算法,成功鉴定出成年人海马区存在着真正的增殖神经前体细胞,极大丰富了对成人神经发生动态机制的认知。 成人海马区神经前体细胞的鉴定具有重大的理论和临床意义。理论上,这关系到人类如何保持神经可塑性,保证记忆形成与情绪调节的长期稳定;临床上,则为各种神经退行性疾病如阿尔茨海默病、抑郁症等提供潜在的治疗靶点。
此前由于技术限制,研究人员难以精准捕捉和分析那些稀少且状态多变的神经前体细胞,导致对于成人神经发生存在大量误解和质疑。此次研究克服了传统组织学和免疫组化技术的不足,通过分析从新生儿到成人不同年龄段的人类海马组织样本,结合单细胞转录组测序,系统描述了神经前体细胞各发育阶段的基因表达谱。 采用的先进单核RNA测序技术能够从复杂的组织中分离出单个细胞或细胞核,捕捉到其转录组信息。该方法不依赖于细胞形态学,适合人脑组织中复杂神经细胞群的精准解析。在此基础上,研究团队引入机器学习算法,通过训练模型识别典型的增殖细胞标志,如细胞周期相关基因Ki67,成功筛选出那些处于活跃增殖状态的神经前体细胞群体。对比实验还显示,这些细胞的分子特征与小鼠和猪的神经前体细胞有高度相似性,提示其进化保守性与功能重要性。
研究结果表明,在成人海马的齿状回区域依然保留着具有增殖能力的神经前体细胞,这些细胞可能伺机分化成为神经元,参与神经回路更新及功能维护。此前部分科学家因难以检出明显的增殖细胞,提出成人神经发生可能在早期儿童时期显著减少甚至终止。对此,研究团队指出单核RNA测序对于稀少细胞的检测存在固有限制,且高特异性的算法筛选往往以牺牲敏感性为代价,导致对实际神经前体细胞数量的低估。通过结合组织切片的RNA原位杂交和空间转录组技术,团队清晰地验证了神经前体细胞在多名成年常人脑组织中的分布与数量,证明成人海马区持续存在神经增殖活动。 这一发现不仅回应了长期存在的科学质疑,也为理解人类神经系统的可塑性开辟了新的视角。成人海马神经发生可能协助脑功能的适应和恢复,在认知灵活性、情绪调控等方面发挥关键作用。
伴随着年龄增长及神经退行性疾病发展,神经前体细胞数量和活性下降或将成为导致神经功能减退的重要机制之一。因此,进一步深入探索其分子调控网络,寻找促进神经前体细胞增殖和功能发挥的方法,具有极大的临床应用潜力。 从方法学角度看,研究借助高通量单细胞组学的解析优势结合人工智能工具,代表了未来神经科学研究的技术方向。通过整合多模态数据,包括转录组信息、蛋白质表达和空间定位,科学家能够构建更加全面细致的神经细胞生态系统图谱。同时,机器学习模型可通过不断训练优化,实现对微弱信号的敏感捕捉,助力发现罕见细胞类型与动态变化过程,为脑科学开启了新的里程碑。 当然,尽管取得了显著进展,对于成年人大脑中神经发生的规模和功能意义仍需进一步精确界定。
尤其是神经前体细胞的增殖频率、分化潜能以及生成神经元的成熟和融入程度,目前尚存在诸多未知。未来结合活体成像、功能评估以及遗传标记技术,将有助于揭示这些新生神经元在认知过程中的切实贡献。此外,环境因素、生活方式、病理状态对神经发生的影响亦值得深入研究,以寻求促进脑健康的新策略。 综上所述,最新研究以严谨的科学方法和创新的技术手段,成功鉴定了成人海马区中增殖神经前体细胞的存在。这不仅为争议已久的人类成人神经发生提供了有力分子证据,也为揭示神经系统终生再生和修复机制奠定了基础。随着研究的不断深入,未来有望借助这些知识推动神经疾病的治疗手段创新,最终惠及广大患者与社会。
人类大脑的神奇可塑性再次被科学探索所映照,孕育着无尽潜能与希望。