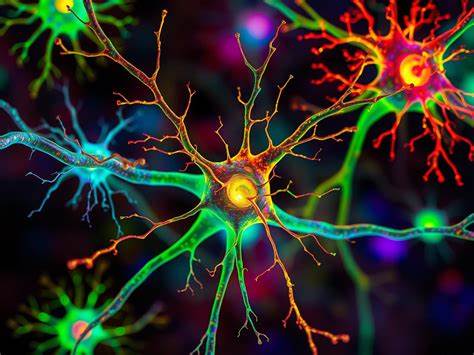
近年来,迷幻药(如LSD、DMT和psilocybin)在精神健康治疗领域重新引发热烈讨论。大量临床试验显示,这类化合物在治疗重度抑郁、焦虑以及戒断相关障碍上具有显著疗效,推动了迷幻医学的临床化探索。然而,对于迷幻药如何在神经回路层面发挥作用的基本理解,长期以来主要围绕一种假设:它们必须直接作用于含有5‑羟色胺2A受体(5‑HT2A受体)的神经元,从而促进这些神经元的突触可塑性与网络重构。最近一项由密歇根大学完成并发表在Molecular Psychiatry的研究(DOI: 10.1038/s41380-025-03257-w)挑战了这一基本假设,结果显示迷幻药能够增强大量不表达5‑HT2A受体的皮层神经元的突触连接,暴露出更广泛的治疗潜力与需要审慎评估的风险。 研究如何颠覆既有认知 传统观点认为,迷幻药的主要靶点是前额叶皮质中高表达5‑HT2A受体的神经元,尤其是那些直接介导感知、意识与情绪调控的回路。许多研究也正是基于这一受体依赖性模型,解释迷幻体验与治疗效果之间的关系。
密歇根大学团队的起点是对全皮层神经元基因表达的系统性绘制。他们发现某些脑区,尤其是后扣带皮层(retrosplenial cortex,RSC),几乎不表达5‑HT2A受体。后扣带皮层在记忆、空间定位、自我投射与情景化记忆中扮演关键角色,也是阿尔茨海默病早期受影响的区域之一。 更令人意外的是,当研究团队对这些缺乏5‑HT2A受体的神经元进行迷幻药处理后,电生理记录与形态学分析都显示出明显的神经可塑性增强,表现为突触输入的增加和树突结构的改变。这一发现直接表明,迷幻药的促进可塑性效应并不完全依赖神经元自身表达5‑HT2A受体的状态。 研究方法亮点与可信度评估 该项研究结合了多种现代神经科学工具,增强了结论的说服力。
研究团队首先利用单细胞转录组学或类似的基因表达谱分析全面描绘皮层不同区域的受体表达分布,确定后扣带皮层等区域为低表达5‑HT2A受体的靶点。随后采用切片电生理记录与形态学染色方法直接测量迷幻药对这些神经元的生理与结构效应。关键性实验还使用了CRISPR‑Cas基因编辑技术,以在体内或在特定细胞亚群中敲除或调控5‑HT2A受体,从而检验受体在可塑性诱导中的必要性。 这种多层次、多方法的实验设计减少了单一技术偏差的可能性,使结论更为稳健。研究由国家卫生研究院(NIH)等资助,并由相关领域的同行评议期刊发表,体现出较高的学术规范与透明度。当然,任何一次科学突破都需要更多独立重复和不同实验条件下的验证,以便全面评估其普适性与生理学意义。
机制上的可能解释 为什么缺乏5‑HT2A受体的神经元仍能在迷幻药作用下展现可塑性?研究团队的CRISPR实验提出了新的规则:迷幻药可能通过复杂的网络间接调节而影响不表达该受体的细胞。具体机制可能包括以下路径:一类神经元直接表达5‑HT2A受体并对迷幻药敏感,其活动变化进而通过局部网络 - 抑制性中间神经元、丘脑输入或胶质细胞 - 影响邻近或远端不表达该受体的神经元,最终引发突触可塑性的连锁反应。另一个可能性是迷幻药对血管、免疫或代谢微环境的影响间接改变了局部突触稳定性与蛋白合成,从而促进可塑性。 这些间接机制强调了神经系统是一个高度耦合的复杂网络,单一受体的激活可以通过多条回路路径放大片段效应,导致广泛而出乎意料的神经重塑。 临床与治疗层面的深远影响 研究成果对迷幻医学的临床应用具有双重启示。积极的一面,若迷幻药能增强无5‑HT2A受体神经元的可塑性,那么其治疗潜力不仅限于前额叶相关的情绪疾病,还可能扩展到那些以后扣带皮层或其他低表达区域功能障碍为核心的疾病。
例如,后扣带皮层在阿尔茨海默病早期出现功能衰退,若迷幻类化合物能够恢复或增强该区域的突触连接,就有望成为阿尔茨海默病早期干预的新思路。此外,创伤后应激障碍(PTSD)常涉及记忆重构与情境记忆网络的异常,增强相关网络的可塑性或能促进记忆整合与减弱病理性记忆的支配地位,从而带来治疗收益。 另一方面,这一发现也带来重要警示。迷幻药作用范围比预期广,意味着其在临床使用中可能触及并改变我们尚未充分了解或希望保持不变的神经网络。非靶向的可塑性增强可能在短期产生积极疗效,但长期后果未知,甚至有潜在的认知或情绪副作用。因此在推进临床应用时,需要更严格的剂量控制、更细致的患者选择标准以及长期随访的安全评估。
研发新一代更有针对性的药物的可能性 这项研究也为新药研发提供了新思路。既然迷幻药的网络效应可以跨越受体表达差异,科学家可以探索两类策略:一是设计能够更精准局部化作用的迷幻类似物,通过调整受体偏向性、药代动力学或分布特性,将可塑性效应限制在目标回路;二是开发能够模拟迷幻药后网络级可塑性诱导下游信号的分子或小分子组合,而无迷幻作用产生的强烈主观体验。后一方向特别有吸引力,因为它可能保留治疗益处同时降低在临床推广中遇到的监管与安全障碍。 从实验室到临床的关键步骤 要将这些发现转化为临床疗法,需要经过系统性的预临床与临床试验。首先需要在动物模型中验证迷幻药对后扣带皮层等区域功能恢复的长期效果,评估其对认知、记忆与情绪行为的影响及安全性。接着应开发合适的生物标志物来监测目标脑区的可塑性改变,例如功能性磁共振成像、脑电图模式或外周分子指标。
随后才是受控的人体试验,优先选择有明确病理定位且传统疗法效果有限的患者群体,如早期阿尔茨海默病与难治性PTSD患者。在整个过程中,伦理审查、严格知情同意与长期随访都是不可或缺的环节。 伦理、监管与社会层面的考量 迷幻药的历史充满争议,社会与监管机构对其重新合法化与医疗化保持谨慎态度。新研究提示迷幻药影响更广,意味着监管框架需要同步调整。医学伦理上必须重视患者的自主权与知情决策,同时确保治疗团队具备足够的专业能力来管理可能出现的心理和神经生理副反应。政策制定者与公众教育也应跟进,避免对潜在疗效的过度宣传或不切实际的期望。
研究局限与未解之谜 尽管研究突破性显著,但仍有若干未解问题。不同迷幻药分子的受体谱、剂量依赖性与时间窗如何影响这种跨细胞类型的可塑性尚需阐明。此外,动物模型与人类大脑在网络组织与复杂认知功能上存在差异,实验结果能否完全外推至人类临床情境仍需谨慎。还有必要弄清迷幻药诱导可塑性的具体分子通路,包括基因表达、蛋白质合成、局部代谢与胶质细胞参与的角色。 未来研究方向建议 未来研究应着重开展以下方向的探索:系统比较不同迷幻活性分子在多脑区的受体依赖性与可塑性效应,利用高分辨的成像与单细胞组学揭示时间维度上的细胞响应动态,开发针对性更强或副作用更低的"迷幻样"化合物,以及在动物模型中评估长期记忆与认知功能的结果。同时,跨学科合作亦非常重要,神经科学家、精神科医生、药理学家与伦理学家需要共同制定研究与临床转化的标准。
总结性思考 密歇根大学的研究提示我们对迷幻药机制的理解需要重新校准。迷幻药并非只对表达5‑HT2A受体的少数神经元发挥作用,而可能通过复杂的网络效应改变广泛神经元的可塑性。这一发现既扩展了迷幻医学的潜在适应症,尤其在阿尔茨海默病与PTSD等领域带来新的希望,也提醒科研与临床界必须更谨慎地评估其安全性与长期影响。未来的研究若能将这一基础发现转化为更精准、安全的干预手段,或将开启神经精神疾病治疗的新篇章。密歇根大学团队的工作为这条道路提供了重要的起点,但路程仍长,科学验证与伦理监管需并行推进,以确保科学进步最终带来可持续且可靠的临床受益。 。