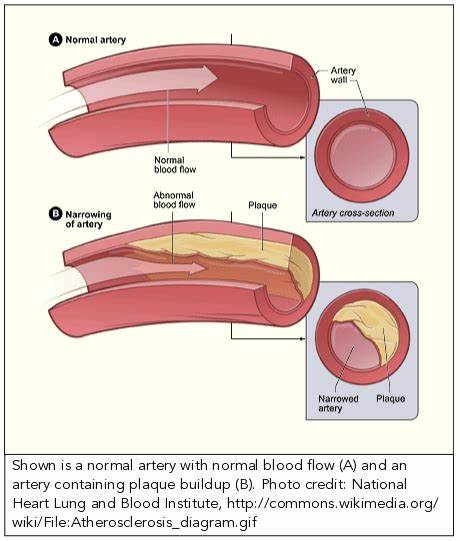
动脉粥样硬化长期以来被认为主要源自血脂异常和胆固醇积累,但随着科学研究的深入,这一传统观点正面临挑战。最新发表在权威科学杂志《自然》上的一项跨国联合研究指出,一种名为咪唑丙酸盐(Imidazole Propionate,简称ImP)的细菌代谢物,与动脉粥样硬化的发生发展存在密切关联。这一发现不仅为心血管疾病的预防提供了全新视角,也推动微生物组学与代谢疾病交叉领域的研究迈入崭新阶段。 咪唑丙酸盐是人体内与特定肠道菌群代谢组分相关联的小分子代谢产物,其来源于氨基酸组分组氨酸的代谢过程。此前研究已确认,ImP参与了胰岛素信号通路的调节,且在糖尿病患者中浓度异常升高,成为代谢综合征的重要生物标志物。这一代谢综合征包括糖尿病、血脂异常、高血压等多种心血管风险因素,揭示了ImP在代谢疾病领域的多重作用潜力。
该研究团队通过分析大规模人群和临床样本,发现ImP浓度与空腹血糖、体重指数、内脏脂肪含量、血脂异常以及血压升高均呈显著正相关,同时与高敏C反应蛋白(hs-CRP)水平升高也呈明显相关,后者是炎症状态的强效指标。令人瞩目的是,这些关联在剔除传统心血管风险因素干扰后依然成立,说明ImP作为独立变量对动脉粥样硬化的贡献不可忽视,提示其可能是心血管疾病风险的重要致病因子。 动物实验进一步验证了ImP的致病功能。研究人员在小鼠模型中人为添加ImP后,发现即使在胆固醇水平未显著改变的条件下,动脉粥样硬化的病理特征依然明显加重。这一结果挑战了传统基于胆固醇假说的动脉粥样硬化解释体系,强调炎症和免疫细胞的激活才是关键驱动因素。 深入机制分析揭示,ImP通过调控骨髓来源免疫细胞的功能,诱导局部和全身炎症状态,进而促进血管壁炎症反应和粥样硬化斑块形成。
核心的分子通路涉及I1型咪唑啉受体(I1R),该受体在免疫细胞信号转导中起着调节作用。借助基因敲除鼠系和受体拮抗剂,研究确认缺失该受体的小鼠能够有效抵抗ImP诱导的动脉粥样硬化,表明I1R的信号通路是治疗干预的潜在靶点。 值得注意的是,ImP不仅影响心血管疾病的发生,亦可能在胰岛素抵抗和糖代谢紊乱中发挥重要作用。这种多重效应说明,针对ImP生成及其信号通路的药物开发,既有望改善胰岛素敏感性,也能降低心血管事件风险,形成对代谢综合征的综合治疗策略。 这项研究对传统心血管疾病风险因子的认知带来颠覆。此前我们长期以胆固醇及血脂水平为指导,实施饮食干预和药物治疗。
然而,长期以来未能解释的心血管事件和个体差异性,现在部分归因于肠道菌群及其代谢产物的作用,从而建立起微生态与心血管健康之间密不可分的联系。 微生物组多样性的失衡可能导致ImP及类似代谢物过度生成,进一步诱发免疫炎症反应。随着肠道菌群研究的发展,未来通过调节菌群组成,减少有害代谢产物的生成,有望成为动脉粥样硬化以及相关代谢疾病防治的创新途径。 目前,对于直接干预I1型咪唑啉受体的药物研发正在筹备阶段。针对该受体的拮抗剂显示出良好的实验效果,但长期使用安全性和系统性影响尚待评估。此外,从调节饮食结构、促进有益菌生长入手,降低ImP生成,将是较为安全且具有推广潜力的预防性手段。
实际应用中结合药物与微生态干预,可能开启个性化精准医疗新时代。 总而言之,细菌代谢物咪唑丙酸盐作为动脉粥样硬化的独立致病因素揭示了一个全新的致病机制,为心血管疾病防控带来了革命性的视角。这一发现不仅加强了代谢综合征、肠道菌群与心血管健康之间的联系,也为未来新药研发和疾病管理提供了坚实的科学基础。推动相关研究深入,阐明更完整的信号网络及其调控机制,将对提升全球心血管疾病防控效率产生长期深远的影响。我们正处于一个革新心血管疾病治疗理念的关键节点,未来数年该领域的进展值得期待。 通过持续关注微生物代谢物对人体健康的影响,结合现代生物技术与临床医学的融合,必将推动心血管疾病预防治疗迈向更精准、高效的新纪元。
。