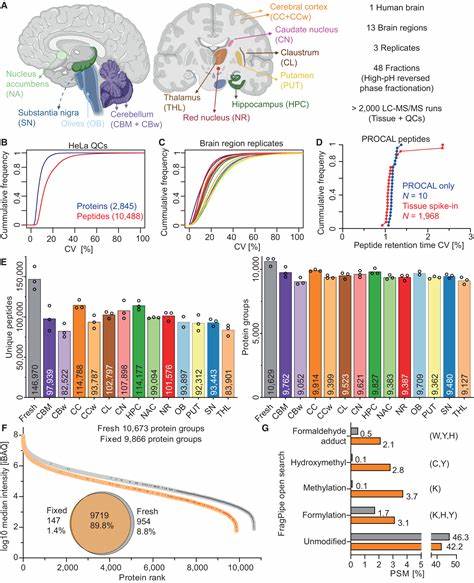
古蛋白质组学作为一门新兴的交叉科学,正逐渐改变人们对古代软组织保存和分析的传统认识。长久以来,考古学和古生物学的研究重心主要集中于矿化硬组织如骨骼和牙齿,其原因在于这些组织较软组织更加稳定,易于保存和采样。然而,人体内的软组织如脑、肌肉和内脏却富含更加复杂的分子信息,能够提供关于古人类生理状态、疾病状况以及生活环境的珍贵线索。近日,牛津大学的研究团队成功开发出一套革新的古蛋白质提取和识别方法,使得科学家们第一次能够从200年前保存的人类大脑标本中获得超过1200种蛋白质,开创了古蛋白质组学研究的新篇章。古蛋白质的研究价值远远超过DNA,因为蛋白质多样并且稳定,它们能反映机体的实际功能状态及疾病表现。尤其在人类行为、认知能力和神经疾病的探索领域,蛋白质信息提供了前所未有的视野。
此前,由于软组织中细胞膜和复杂结构的存在,蛋白质提取一直面临巨大挑战。牛津大学团队通过实验比较了十种提取策略,最终发现尿素作为细胞膜破坏剂效果最佳。尿素不仅能够有效打破细胞膜释放内部蛋白,还保持了蛋白质的完整性,为后续的液相色谱和质谱分析奠定了基础。液相色谱-质谱联用技术通过根据蛋白质的质量和电荷对其进行分离与鉴定,而该团队进一步引入高场非对称波形离子迁移谱技术,通过电场对离子的分离,使检测到的蛋白种类提升了40%。这一创新显著提高了蛋白识别的准确性和覆盖范围,为解析复杂样本中的多样蛋白质提供了强有力支持。值得一提的是,团队所分析的样本来源于19世纪英国布里斯托尔一处维多利亚时代贫民医院墓地,保存状态良好,脑组织外层覆盖着含铁氧化物的红色沉积物。
通过对这些组织深度分析,科学家不仅识别出维持脑健康功能的核心蛋白,还发现了与阿尔茨海默病和多发性硬化等神经系统疾病相关的潜在生物标志物。传统骨骼考古无法揭示这些非骨骼疾病的存在,因此该研究对理解古代人群健康状况和疾病谱具有里程碑意义。此外,软组织中约有75%的蛋白表达种类,远多于骨组织中的不到10%。这意味着通过软组织蛋白质组学研究,我们能够获得更加丰富和准确的生物学信息,深入理解古代人类的饮食结构、环境适应和疾病变化。牛津大学中心的负责人Roman Fischer教授指出,此次工作通过检索古代软组织中的病理蛋白标志物,极大地拓展了人类健康历史的研究视野,为未来考古医学和进化疾病学研究奠定坚实基础。该技术的潜力得到了广泛关注,其应用范围涵盖冻干木乃伊、泥炭沼泽遗体以及各类历史遗存中的抗体和肽类激素。
剑桥大学动物学系的Christiana Scheib博士评价,此项研究的实验设计严谨,是推动史前软组织蛋白质组学迈入新阶段的重要里程碑。她期待未来借助该技术从古代软组织中挖掘出更多有关进化历史和病理机制的关键信息。随着技术的成熟,古蛋白质组学将融合现代分子生物学和考古学手段,深度解析远古时代的生物学秘密。不仅是人类历史,未来或将推动古代动物、植物及微生物研究的飞跃进展。软组织蛋白可作为解码古代生命状态标志,为当前研究难以触及的领域提供突破口。此次研究意义不仅在于技术突破,更在于打开了通往古代健康与疾病的探索大门。
尽管DNA在遗传研究中占据核心位置,但蛋白质更贴近生物体实际功能表达,有助于揭示遗传信息背后的表型表现。利用古蛋白质组技术,科学家未来可追踪疾病起源、传播甚至进化过程,重构远古人类的生活方式与生理适应。这些发现有望推动医学史、进化神经科学和人类学的交叉融合。展望未来,古蛋白质组学或将成为研究人类起源、迁徙及古疾病谱的重要工具。对很多无法提取DNA的样本,古蛋白质组学提供了一条全新的研究路径。结合先进的质谱仪和生物信息学分析,科研人员将不断挖掘出珍贵信息,提升对生命演化及环境影响的理解。
总之,古蛋白质组学的进步不仅为考古学注入新活力,也为医学、进化生物学等多学科带来深远影响。牛津大学团队的成果令人振奋,预示着未来考古科研将更加深入地探讨人类软组织保存与遗传信息的关系,进一步揭示古代疾病的本质,推动古代软组织生物信息学迈向新高度。