艾滋病毒(HIV)感染持续威胁全球公共健康,尽管抗逆转录病毒治疗(ART)有效控制病毒复制,但根除病毒仍面临巨大挑战。HIV在静息的CD4+ T细胞中形成潜伏感染库,这些细胞内集成的病毒基因组处于转录沉默状态,无法被现有药物清除,成为病毒复发和持续感染的根源。近年来,RNA技术的飞速发展赋予科学家全新的工具,其中基于脂质纳米颗粒(LNP)的mRNA递送平台,为靶向治疗带来了前所未有的可能性。尤其是在激活艾滋病毒潜伏感染领域,有望克服传统药物的局限,实现真正意义上的病毒清除。 潜伏感染是艾滋病毒难以根治的核心障碍。病毒整合到宿主细胞基因组之后,在静息CD4+ T细胞中以无活性的潜伏状态存在,难以被免疫系统识别,也难以通过常规药物激活。
现有的潜伏逆转剂(LRAs),例如组蛋白脱乙酰化酶抑制剂,虽能诱导病毒部分转录活性,但未能彻底激活病毒全生命周期,且伴随一定免疫细胞功能抑制和毒性,限制了其临床应用效果。通过靶向延长转录并增强病毒专一性激活,有望提升潜伏病毒的表达和清除效率,从而实现“踢醒并杀死”(shock and kill)策略的关键环节。 基于mRNA的治疗策略,特别是通过LNP将编码病毒关键转录激活因子的mRNA递送到靶细胞,开启了一条全新的途径。最新的研究报道了一种创新LNP配方(称为LNP X),其以SM-102为主离子化脂质,并采用β-谷甾醇替代传统胆固醇,实现了对静息CD4+ T细胞的高效无毒转染。该LNP X能在无须细胞预激活的情况下,使超过75%的静息T细胞成功接受mRNA,显著打破了以往基于Patisiran等传统LNP方案必需刺激T细胞才能高效递送mRNA的瓶颈。更令人振奋的是,LNP X传递的mRNA不仅进入细胞质,更是经过高效翻译,产生活性蛋白质,实现强效基因表达调控。
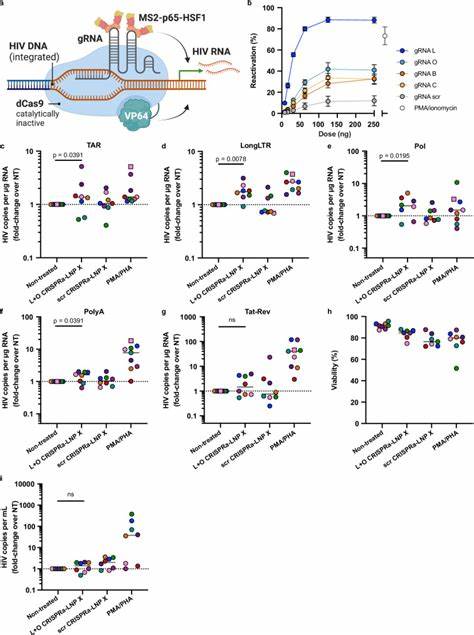
获得LNP X高效递送效能的关键因素,除了离子化脂质的替换外,β-谷甾醇的引入显著增强了纳米颗粒与细胞表面的结合力及内吞吸收,进而提高细胞摄取率和翻译效率。巧妙地调整脂质的分子比例,确保了纳米颗粒的理化性质适合静息T细胞的摄取机制。这不仅提升了mRNA在细胞质中的稳定存活,还绕过了内吞途径的降解限制,保证表达持续而高效。此发现推动了纳米递送系统对免疫细胞精准调控的研究进展。 针对HIV潜伏逆转的治疗策略,研究小组利用LNP X递送编码HIV转录激活蛋白Tat的mRNA。Tat蛋白通过结合病毒长末端重复序列(LTR)中的转录响应元件,促进转录延伸和RNA处理,极大激活病毒转录。
但是在以往尝试中,Tat蛋白mRNA的递送受限于低效转染和潜在毒性,效果有限。LNP X的出现彻底提升了Tat蛋白mRNA在静息CD4+ T细胞中的表达。实验证明,Tat-LNP X能有效逆转离体患者的潜伏病毒,诱导多种不同HIV RNA转录本的大幅表达,包括未经剪接和多重剪接的转录物,表明其突破了病毒转录中的多个阻滞步骤,且诱导的活跃病毒RNA超越传统T细胞激活剂带来的效果,且未引起全局T细胞激活,减少脱靶风险。 此外,研究还探讨了LNP X共递送CRISPRa系统,即基于无活性的dCas9融合转录激活域,并辅以辅助蛋白模式以增强转录激活能力,实现基因组定位激活。CRISPRa提供了针对HIV LTR高度特异性的调控能力,避免传统小分子药物的非特异性影响。实验中,搭载设计的gRNAs的CRISPRa-LNP X成功在体外静息T细胞中诱导目标基因CD25表达上调,且在ART抑制治疗的HIV感染者CD4+ T细胞中有效激活多个HIV转录本。
虽然CRISPRa-LNP X诱导的潜伏逆转效能稍逊于Tat-LNP X,但展现了良好的细胞兼容性和高度特异性,显示作为下一代潜伏逆转剂的广阔应用前景。 以上发现综合表明,基于LNP X的mRNA递送平台具有重大潜力用于开发针对静息T细胞的基因治疗技术,不仅限于HIV潜伏逆转,还可拓展至免疫疗法、基因编辑等领域。相比电穿孔和病毒载体等传统转染方法,LNP X展现无细胞毒性、操作简便及高效递送优势,更适合临床转化。 然而,尽管Tat-LNP X诱导了显著的病毒激活,病毒相关细胞清除尚未显著发生,提示仅依赖潜伏逆转剂可能无法根除潜伏病毒库。未来工作需结合免疫调节手段或细胞凋亡增强剂,以协同促进感染细胞消除。同时,LNP X在体内的生物分布、免疫原性及安全性评估也是推进临床应用的重要方向。
定向递送策略的发展,可进一步提升疗效及降低副作用,打造精准高效的抗HIV治疗手段。 总体而言,LNP X为mRNA药物递送提供了突破性的技术创新,成功实现了静息T细胞的高效转染与基因表达,为HIV潜伏逆转带来了强大的新武器。基于此平台,未来有望开发多款针对病毒和宿主因素的核酸药物,推动艾滋病功能性治愈临床目标的实现。同时,其延展性和安全性优势,有望带动免疫细胞基因疗法的新一轮技术革新,造福更广泛的疾病治疗需求。