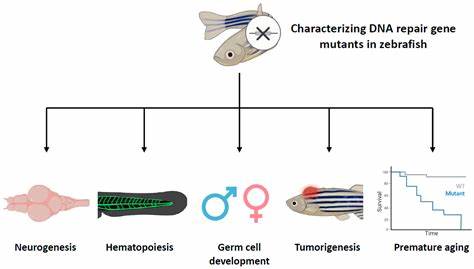
斑马鱼因其卓越的器官再生能力而备受科学界关注,尤其是在心脏损伤后的修复能力上展现出非凡的潜力。最新由加州理工学院和加州大学伯克利分校合作进行的研究,深入解析了斑马鱼心脏再生背后的基因调控机制,揭示了一组特殊的基因电路控制着这一复杂的生物过程。研究成果不仅帮助科学家们理解斑马鱼的再生机制,更为人类心脏病的治疗打开了新的思路和可能性。 心脏作为人体的重要器官,其损伤恢复一直是医学领域的难题。传统观点认为成年哺乳动物的心脏细胞再生能力极为有限,这也是造成心脏病患者难以完全康复的主要原因。而斑马鱼与人类虽然存在生理结构和进化上的差异,却拥有部分相似的细胞类型,特别是神经嵴细胞,这在心脏的多样细胞群中扮演着至关重要的角色。
神经嵴细胞是一类起始于胚胎发育早期、具有高度多能性的干细胞,这类细胞不仅在面部骨骼、神经系统发育上发挥关键作用,也参与心脏组织的构建。研究发现,斑马鱼心脏中约有12%至15%的细胞源于神经嵴细胞,这部分细胞在心脏损伤修复过程中主动调控和引导再生机制。科学家采用先进的细胞追踪和基因编辑技术观察神经嵴细胞的动态变化,发现它们释放出协调受损组织重建的信号,并激活特定基因群,启动心脏细胞的分裂与分化。 值得关注的是,斑马鱼再生心脏过程中激活的基因组与胚胎早期心脏发育所需的基因高度重叠。这表明心脏再生过程实际上是对胚胎时期基因表达程序的重新激活。科研团队通过深入分析基因调控网络,发现这些关键基因在成年斑马鱼中通常处于关闭状态,仅在受伤后方被唤醒,进而启动组织修复机制。
这种基因的“开关”机制让研究人员产生了巨大兴趣,因为如果能弄清楚激活信号的来源和模式,将有望实现对人类心脏细胞类似基因程序的诱导。 目前,加州大学伯克利分校的研究团队正利用CRISPR基因编辑技术,在体外培养的人类心脏细胞模型中尝试激活斑马鱼心脏再生中发现的基因。这项研究既具有挑战性,也充满潜力,从根本上突破人类难以自我修复心脏的医学障碍。若这一技术得以实现,它将为心肌梗死、先天性心脏缺陷等病症的治疗带来革命性进展。 除了基因激活的难题,研究者们还关注再生过程中的细胞通讯、环境信号及免疫反应对心脏再生的影响。斑马鱼的再生能力之所以强大,部分原因在于其体内微环境能够支持细胞的高效再生和整合。
通过解析这一复杂的细胞和分子相互作用,有望设计出模拟或增强人体内环境的干预策略,促进受损心脏组织的再生。 此次发表在《美国国家科学院院刊》上的论文,首次系统描绘了斑马鱼心脏神经嵴细胞的转录谱再激活机制,为再生医学领域注入了新活力。研究由加州理工学院生物学教授兼贝克曼研究所所长Marianne Bronner和加州大学伯克利分校发育生物学家Megan Martik领导,他们在神经嵴细胞领域的基础研究为这一进展打下了坚实基础。 这项工作得到了美国心脏协会、Shurl and Kay Curci基金会、美国国立卫生研究院及国家科学基金会等的支持,显示出科学界对心脏再生研究的高度重视。Marianne Bronner作为天桥与Chrissy Chen神经科学研究所的兼职教授,充分体现了跨领域合作在这一研究中的重要作用。 展望未来,科学家们计划进一步探明损伤信号如何触发神经嵴细胞激活心脏再生基因网络,解开更深层次的生物学密码。
同时,转化医学研究将提升对人类自身潜在再生能力的理解,推动开发基于基因和细胞水平的新疗法。斑马鱼心脏再生的研究不仅为基础生物学提供了珍贵模型,也为心血管疾病治疗带来了切实希望。 人类社会正面临日益严重的心血管健康危机,心脏病已成为全球范围内的主要死亡原因之一。寻找有效的心脏损伤修复方法刻不容缓。斑马鱼作为自然界中有限的心脏再生能手,其潜能和机制的探索正带来突破性的医学创新契机。通过整合基因编辑技术、干细胞生物学及分子医学,未来有望实现对人类心脏细胞的基因程序重塑,从而激发其再生潜能,恢复正常功能。
总而言之,斑马鱼修复受损心脏的基因密码研究不仅深化了对再生生物学的理解,也为人类心脏疾病的未来治疗描绘了蓝图。科学家们通过揭示神经嵴细胞及其相关基因的关键作用,正在逐步解锁生命系统自我修复的奥秘。随着技术和理论的不断进步,或许在不远的将来,人类能够借鉴斑马鱼的再生法则,实现心脏等重要器官的有效修复,造福全球患者,开创再生医学新纪元。