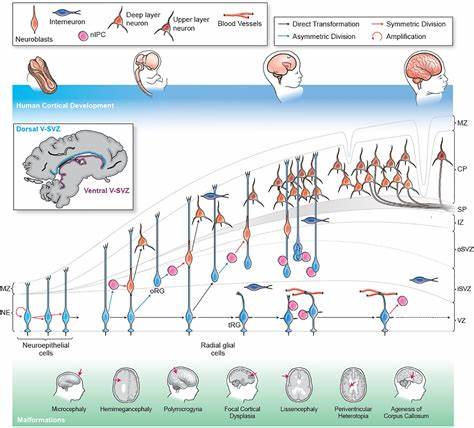
大脑皮层作为人类高级认知功能的核心结构,其发育异常被认为是多种神经发育障碍和皮层疾病的根源。近年来,研究人员结合人类神经干细胞(NSCs)体外模型与单细胞转录组测序等前沿技术,深入探索了皮层疾病的早期发育机制,为疾病的诊断和治疗提供了科学依据。神经干细胞在大脑胚胎发育的早期阶段起着至关重要的作用,它们不仅是生成神经元与神经胶质细胞的祖细胞,还受制于组织区域的时空形态指令,塑造大脑的复杂结构。然而,这些细胞的功能障碍或基因表达异常,极有可能导致神经发育异常病理的形成,甚至在出生前便种下疾病的根基。研究表明,神经干细胞的不同发育阶段对应着不同的疾病风险窗口,不同疾病背后的风险基因在细胞进展中呈现出特异的时空表达模式。在人类皮层发育的早期,脑区组织中心分泌形态发生蛋白(morphogens),引导神经干细胞的区域性身份决定及命运转化。
成纤维细胞生长因子(FGF)、WNT、SHH等关键信号通路对神经干细胞的增殖与分化具有精细调控作用。通过调节FGF2剂量和培养条件的体外NSC模型,可以模拟这些早期发育过程并追踪基因表达动态。此外,不同类型的遗传突变,如微小染色体拷贝数变异、点突变及单细胞水平的体细胞嵌合突变,均可能扰乱神经干细胞的基因调控网络,激发一系列皮层发育疾病,包括小头畸形、脑回少裂、焦点性皮层发育不良、以及广泛的神经精神疾病如自闭症谱系障碍和精神分裂症。对于这些复杂病因,研究团队通过综合分析遗传数据集,筛选出与皮层异常相关的数千个疾病风险基因,并结合人类胚胎早期脑组织的单细胞测序数据,定位了这些基因在神经干细胞和神经谱系分化过程中的特异表达。当基因在特定的发育阶段集中表达时,该阶段被视为疾病的关键易感窗,提示该时段神经干细胞对突变更为敏感。更为重要的是,利用基因调控网络推断工具如RcisTarget与CellOracle,研究者解码了核心转录因子与其靶基因之间错综复杂的调控关系。
发现数十个核心水印基因转录因子参与多种疾病的致病网络,这些转录因子在神经干细胞的不同发育阶段形成有序调控梯度,调节细胞命运和区域特殊化。并且,模拟转录因子功能失调的细胞轨迹变化,揭示了基因调控障碍如何导致神经谱系迁移异常、增殖失调及细胞类型比例异常等发育缺陷。自闭症患者来源的诱导多能干细胞衍生神经干细胞在体外系统中展现了类似的基因表达异常,尤其是在调控脑区定位和神经干细胞命运承诺的关键转录因子上频繁出现异常表达。这种体外模型不仅精准还原了患者的早期神经发育分子特征,同时也反映了不同患者之间的个体化遗传和表型差异,助力未来个性化的疾病机制和治疗策略研究。此外,多个跨物种的比较研究表明,人类皮层神经干细胞的转录调控网络虽基本保守,但存在特殊的调控模式和关键转录因子,可能与人类独特的认知能力和大脑皮层复杂性相关。因此,利用人类神经干细胞体外模型检验这些专有调控机制,对于理解人类特异性皮层疾病的发病机制尤为重要。
值得一提的是,该领域的进展不仅拓展了神经发育病理的理解,还促使新一代实验模型的发展,例如类器官技术和多组学联合分析,为疾病早期诊断和治疗窗口的界定奠定基础。通过精细调控神经干细胞关键转录因子的活性,未来有望实现病理机制的定向干预,改善因皮层发育障碍引起的神经精神疾病预后。总之,围绕早期神经干细胞发育动态的深入研究,正推动我们对皮层疾病起源的认识进入前所未有的维度。结合先进的实验模型和计算方法,将揭示更多遗传风险和转录网络的复杂交织,有助于未来打破疾病异质性障碍,并为精准医学提供理论与实践指导。