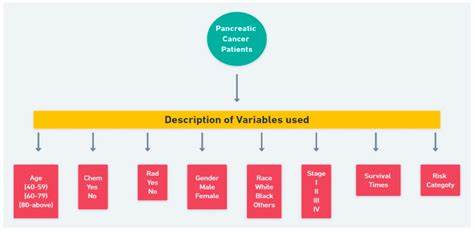
胰腺癌作为世界上致死率极高的恶性肿瘤之一,因其早期症状隐匿且缺乏有效的筛查手段,往往在发现时已处于晚期,极大地限制了治疗效果和患者生存率。近年来,随着人工智能技术特别是序列模型在医疗数据分析中的应用,胰腺癌风险预测领域迎来了新的突破。通过对患者历史健康数据、基因信息、生活习惯以及医学影像等多模态数据的时间序列分析,研究人员能够更精准地识别高危人群,实现早期干预。序列模型,顾名思义,是专门用于处理序列数据的机器学习模型,能够捕捉时间依赖性和动态变化的特征。常见的序列模型包括循环神经网络(RNN)、长短期记忆网络(LSTM)、门控循环单元(GRU)以及近年来广泛应用的变换器模型(Transformer)。这类模型在胰腺癌风险预测中的优势在于它们能够有效整合患者动态的健康指标,辨识潜在的疾病发展轨迹。
胰腺癌的发病涉及复杂的基因突变、环境因素和代谢变化。传统统计模型难以捕捉其非线性和多层次的交互关系。而序列模型通过深层神经网络结构,实现对多变量数据的建模,能够挖掘潜在的生物学模式。举例来说,利用患者随访期间的血液生化指标和影像学检查结果输入LSTM模型,即可预测未来几个月甚至几年的胰腺癌发生风险,这对于制定个性化的监控计划至关重要。除了健康指标的时间序列外,基因组数据的时序分析也日渐受到关注。胰腺癌的基因变异如KRAS、TP53等在不同时间点的表达变化,为疾病风险评估提供了关键线索。
序列模型能够利用这些时序基因表达数据,结合临床信息,构建综合性风险评估模型,提升预测的准确性和灵敏度。医学影像中的序列数据同样重要。近年来动态对比增强磁共振成像(DCE-MRI)和多时间点CT扫描被用作胰腺癌的诊断辅助手段。通过对多时点影像数据的序列建模,研究者能够自动识别病灶变化,辅助判断肿瘤进展情况。此外,序列模型在处理电子健康记录(EHR)方面展现出巨大潜力。胰腺癌患者的症状和实验室检测数据往往分布在多次就诊记录中,传统方法难以整合利用。
序列模型通过对患者历次门诊及住院记录的时间序列分析,不仅可以预测发病风险,还有助于识别潜在的临床预警信号。然而,胰腺癌风险预测中的序列模型也面临诸多挑战。首先,数据质量和完整性是制约模型性能的关键。胰腺癌相关的多模态数据通常量少且不均衡,如何有效处理缺失值和噪声数据,将直接影响模型的泛化能力。其次,模型的可解释性问题亟待解决。临床医生需要理解模型预测结果背后的逻辑才能放心应用于临床决策,因此将"黑盒"深度学习模型转化为可解释形式,是实现临床落地的关键。
在实践中,越来越多的跨学科团队开始尝试将序列模型与传统统计学方法结合,利用机器学习解释技术如注意力机制(Attention)和特征重要性排序,提升模型透明度。同时,采用联邦学习等分布式训练方法,保护患者隐私,促进多中心数据共享,也成为胰腺癌风险预测模型开发的新趋势。值得一提的是,序列模型还为胰腺癌的个性化治疗提供了数据支持。通过整合患者的时间序列基因组和临床数据,模型能够辅助预测对不同治疗方案的反应,帮助制定精准治疗计划,优化疗效。未来,随着多模态数据采集技术的发展和计算能力的提升,序列模型将在胰腺癌风险预测中发挥更重要的作用。进一步结合人工智能生成对抗网络(GAN)进行数据增强,以及利用半监督和无监督学习方法发掘隐含模式,有望突破现有精度瓶颈。
此外,移动设备和可穿戴传感器的普及,使得实时健康数据采集成为可能,序列模型可实现动态、个性化的风险监控和预警,为胰腺癌早筛提供全新技术路径。综上所述,基于序列模型的胰腺癌风险预测代表了现代医疗和人工智能结合的前沿方向。通过深刻洞察时间维度上的患者信息变化,精准识别高危个体,不仅能够改善胰腺癌的早期诊断率,也为个性化治疗和长期管理奠定基础。未来,伴随着技术和临床应用的不断融合,这一领域将持续推动胰腺癌防治水平迈上新的台阶,惠及更多患者。 。