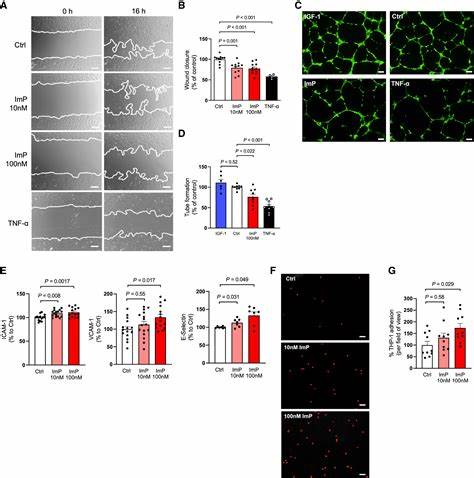
动脉粥样硬化作为心血管疾病的主要病理基础,一直是全球健康领域的重点攻关对象。尽管传统的治疗主要聚焦在血脂异常和炎症反应方面,但越来越多的研究发现,肠道微生物代谢产物对动脉粥样硬化的发生和发展具有显著影响。近年来,组氨唑丙酸(Imidazole Propionate,简称ImP)因其在糖尿病和代谢综合征中的作用而备受关注,而最新研究进一步揭示其在动脉粥样硬化中的驱动作用和治疗潜力,为心血管疾病的早期干预和个体化治疗提供了新思路。组氨唑丙酸主要来源于肠道微生物代谢分解组氨酸的产物,这一代谢途径的活跃性与肠道菌群的组成密切相关。科学实验表明,在高胆固醇饮食的小鼠模型中,ImP的含量显著增加且与动脉斑块面积呈正相关,这一发现暗示其在动脉硬化病理过程中发挥促进作用。与传统的脂质介导机制不同,ImP并不直接改变血脂水平,而是通过激活机体的免疫系统,诱导局部和系统性炎症反应,促进炎症细胞浸润和免疫介导的血管损伤,从而加速斑块生成和发展。
ImP的作用机制核心在于其与宿主细胞中特殊受体——异烟酰胺-1受体(I1R,也称为nischarin)的结合。研究发现,ImP通过激活I1R介导下游mTOR信号通路的启动,促使巨噬细胞和成纤维细胞等关键细胞产生促炎因子及迁移能力增强,造成免疫细胞在血管壁的聚集,加剧血管壁的炎症状态。这一过程不仅加深了动脉粥样硬化的病理改变,还可能导致斑块不稳定,增加心肌梗死和卒中的风险。此外,小鼠模型中通过基因敲除或药物阻断I1R,显著减轻ImP诱导的动脉粥样硬化及炎症反应,表明ImP–I1R通路是潜在的治疗靶点。人类临床研究同样验证了上述发现。通过对健康和无症状早期动脉粥样硬化患者的血浆ImP水平测定,发现高ImP水平与动脉粥样硬化的存在及活动性显著相关。
这种关联独立于传统的风险因素如年龄、性别、血脂水平及炎症指标,突出ImP作为风险评估和疾病监测的新型生物标志物的价值。更为引人注目的是,ImP水平还与特定饮食习惯和肠道菌群生态的变化相关。研究指出,地中海饮食和优质早餐饮食模式与较低的ImP水平呈负相关,而肠道中某些细菌如Veillonella的丰度则与ImP正相关,揭示饮食和微生物调控可能成为干预ImP水平,进而防治动脉粥样硬化的途径。ImP的发现不仅拓展了对动脉粥样硬化发病机制的理解,也推动了治疗策略的创新创新。当前传统疗法主要针对血脂异常和炎症,但部分患者即便在药物治疗下仍存在显著残留心血管风险。针对ImP–I1R信号通路的药物研发显示出广泛的前景,例如特异性I1R抑制剂AGN192403已在动物研究中表现出有效缓解ImP诱导动脉硬化的作用,为临床转化奠定基础。
未来的发展方向应集中于ImP在临床不同阶段动脉粥样硬化中的诊断价值,结合高灵敏度影像学和多组学技术实现早期无创识别高风险人群。同时,理清微生物组、代谢物和宿主免疫系统的复杂交互网络,将助力于精准医疗方案的实施。综上所述,组氨唑丙酸作为肠道微生物的关键代谢产物,不仅是动脉粥样硬化的驱动力,也成为创新治疗的靶点。通过揭示ImP与I1R介导的免疫炎症通路,研究为心血管疾病的早期预警和个性化治疗注入新活力。调整饮食结构和肠道微生态,结合靶向阻断ImP信号传导,未来有望实现更有效的动脉粥样硬化防治策略,提升患者生活质量并降低心血管事件的发生率。随着相关机制与干预方法的深入研究,ImP或将成为心血管慢性疾病管理中的一个革命性标志,开启精准医学新时代。
。