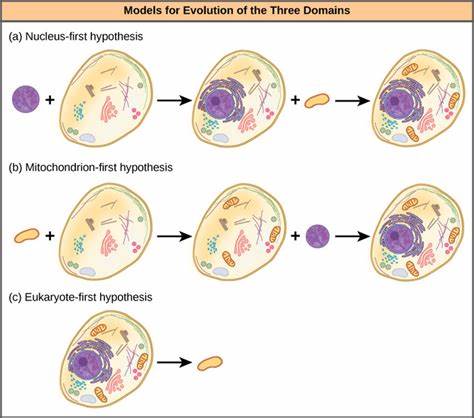
真核生物的基因起源和演化是生命科学中的核心主题之一,揭示了分子创新如何塑造生物复杂性和适应性的关键路径。与传统认知中基因作为相对稳定和界定明确的遗传单元不同,现代基因组学技术表明,基因的产生和丢失是持续而频繁的现象,甚至可以在相对短暂的进化时间尺度内发生。这种动态性为真核生物的功能多样性提供了源源不断的原材料,促进了新表型特征和代谢路径的出现。真核基因组结构的模块性以及非编码DNA的丰富,为基因创新奠定了物质基础。调控可塑性、转座元件的存在及基因组复制机制更使真核基因组成为基因新生的沃土。最新研究也证实,核内染色质的拓扑结构与基因组空间组织,对新基因的表达和固定起到重要调控作用,赋予基因创新以空间维度。
基因的产生并非孤立事件,而是受自然选择、遗传漂变及基因网络整合的多重影响。在众多新基因起源机制中,基因复制被广泛认为是最主要的途径。通过复制产生的基因副本,在维持原有功能的同时,能够积累突变,继而实现功能的分化,包括获得新功能(新功能化)、分工(亚功能化)或功能丧失(假基因化)。这些过程推动了基因家族的形成,并为生物的适应性进化提供基础。以球蛋白基因家族为例,其多轮复制和分化产生的多样亚型,使不同发育阶段或生态环境下的氧运输功能得到优化,如胎儿血红蛋白的高亲和力适应了母胎交换的需要。除整基因复制外,外显子复制及重组也增进了蛋白结构与功能的创新。
有些基因通过串联复制外显子,扩充蛋白结构域数量,从而提高了功能复杂性,例如人类载脂蛋白(a)基因的重复扩展与心血管风险的关联极具典型性。逆转录转座机制则通过mRNA反转录回插基因组,生成新基因复制体(复刻基因),部分复刻基因可获得调控元件并发挥新功能,如与灵长类生殖相关的PGAM3基因。基因融合和分裂重塑了基因结构,使原有基因通过融合生成具新功能的嵌合蛋白,或通过分裂产生基因家族成员,极大地丰富了蛋白质的组合多样性。这些结构变异是物种适应环境及抵御病原体的重要手段。外显子重组更以模块化的方式重排蛋白结构域,创造出多样的蛋白组合,形成新颖且高效的生物功能,例如血浆纤溶酶原激活物基因的形成生动展示了这一过程在功能创新中的地位。去新生基因的诞生代表了基因创新中最具革命性的机制,其过程涉及非编码DNA突然获得开放阅读框及转录翻译活性。
大量基因组和转录组证据支持去新生基因在真核生物中的普遍出现,尤其在人类睾丸组织中的特异性表达暗示其在生殖与物种形成中的潜在作用。孤儿基因则因缺乏同源基因,呈现物种或类群特异性,可能由去新生或快速序列分化产生,这类基因在物种独特性及生态适应中发挥着重要角色。虽然水平基因转移(HGT)在多细胞真核生物中比较罕见,但在单细胞真核生物中,HGT对代谢体系及应答机制的贡献显著,而某些多细胞动物体内,HGT可能通过特殊途径引入重要基因,极大丰富了基因库。病毒基因驯化是另一新颖的基因生成机制,真核生物对内源性逆转录病毒基因的稳定整合和功能共用孕育了如胎盘发育相关的Syncytins基因等关键遗传创新,展现了古老病毒与宿主基因组长期共演化的成果。真核生物特有的可变剪接机制允许同一基因产生多重转录本和蛋白异构体,不仅提高了基因表达的复杂度,也推动了组织特异功能及发育阶段特异性表达,从而为功能多样性提供了无基因数目增加的途径。以DDX4基因为例,人类中此基因的剪接异构体在不同生殖细胞阶段发挥不同的调控作用,反映了剪接机制对进化生殖策略的贡献。
基因在种群中的固定过程深受选择压力及遗传漂变的共同作用。具有适应优势的新基因往往因为正向选择扩散于群体,而环境压力、性选择等均可加速其频率提升。对小群体来说,遗传漂变可能允许运气好的新基因得以固定,为后续功能多样化提供契机。新基因的表达调控兼容性及其与既有基因网络的整合能力,是决定其能否长久保留的关键。初生基因常在睾丸等宽松表达环境中测试功能,逐步获得更稳固的调控模块。进一步复制可产生更多副本,形成多基因家族,通过新功能化或亚功能化实现表达和功能分化,推动复杂性进化。
空间基因组组织同样在新基因进化中扮演重要角色。基因以其三维核内定位及染色质状态决定其转录活性,位于活跃区如富GC高基因密度带的基因更易固定,而定位于异染色质或核膜相关域(LADs)的基因则倾向沉默或丢失。基因组拓扑结构与功能创新紧密配合,赋予基因创新空间选择过滤作用。新基因的功能演化轨迹表现为复制副本间的功能分工(亚功能化)或获得全新功能(新功能化)。调控元件的差异化表达使得即使蛋白序列相同的副本也可在组织和发育阶段实现不同功能。表观遗传调控为新基因提供了临时“沉默”的保护期,使其积累有益突变,同时避免对宿主不利。
许多新基因编码的蛋白为内在无定形蛋白,具高度结构柔性,促进其在细胞功能网络中的多重角色展现,尤其在大脑和免疫系统等快速进化的组织中表现突出。人类和脊椎动物中有数个代表性新基因展现了基因创新的深远影响。如ARHGAP11B起源于ARHGAP11A的部分复制,经突变产生新剪接产物,促进神经基质细胞增生,促进新皮质扩展,显著提升认知能力。NOTCH2NL家族基因通过基因复制及结构变化增强Notch信号通路功能,延缓神经元分化,延长皮质神经发生期,调控脑容量大小;SRGAP2C作为SRGAP2A的截短复制品,抑制神经突触成熟,延长神经发生期间的突触可塑性,是人类大脑灵活性的遗传基础。这些案例展示了去新生及复制基因对人类特有表型形成的贡献。哺乳动物中胎儿血红蛋白基因的复制和调控分工让胎儿适应宫内低氧环境,案例体现了基因复制后调控创新的经典适应例证。
哺乳动物独有的酪蛋白基因群由祖先的牙齿蛋白基因经过复制和功能联合形成,驱动乳汁营养运输系统的进化,是繁殖创新的典范。科研方法层面,比较基因组学、系统发育及基因组软连锁分析帮助追溯基因起源与进化历史。转录组与核糖体测序技术发展推动了低表达及短开放阅读框基因的发现,扩展了基因功能的识别边界。非同义与同义突变比值(dN/dS)等统计工具揭示了基因选择压力方向。基因编辑技术如CRISPR及基于诱导多能干细胞的类器官模型为新基因功能验证提供强有力平台,促进了对基因与复杂性状间因果关系的揭示。未来,核架构与染色质空间组织对新基因表达潜力及进化趋势的跨领域探索将成为热点。
人类泛基因组项目通过纳入全球多样性个体,揭示了传统参考基因组未包含的结构变异和隐秘基因多样性,为个体及群体水平的适应机制与疾病关联研究提供新视角。单细胞多组学结合空间组学技术为追踪基因新生、表达及功能整合提供前所未有的分辨率。通过综合基因组学、表观遗传学、结构生物学和系统生物学的多学科优势,将推动我们对新基因实际功能及生物学意义的深度理解。总体而言,真核生物基因的起源和演化不仅反映了生命复杂性的本质,也揭示了人类独特性的遗传基础。随着多组学与前沿实验模型的推进,未来将更加深入解读新基因如何驱动生物创新、环境适应及疾病发生,塑造我们对进化和临床研究的全新认识。