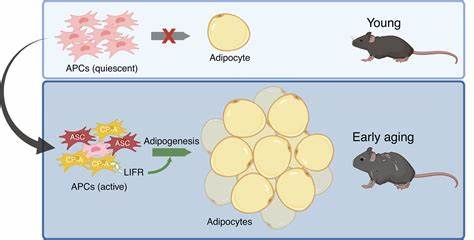
许多人在迈入中年后,会惊讶地发现体重并未显著增加,然而腰围却逐渐扩大,腹部脂肪明显堆积。其实,这并非单纯的生活习惯问题,而是细胞层面的深层次变化导致的结果。最新科学研究来自美国City of Hope国家医学中心,他们通过一系列前临床实验揭示了这一现象背后的重要细胞机制,深刻解释了为什么我们的腰围会在中年不断扩张。研究聚焦于脂肪组织中的一种特殊干细胞——脂肪细胞前体细胞(Adipocyte Progenitor Cells,简称APCs)。这些细胞具有分化成脂肪细胞的潜能,是脂肪组织增长的核心推动力。以往人们认为脂肪细胞主要是体积变大才导致肥胖,但这项研究表明,随着年龄增长,APCs的行为发生根本性转变,开始大量生成新的脂肪细胞,尤其集中在腹部内脏脂肪区域。
研究团队设计了一个巧妙的实验,将年轻和年长小鼠的APCs分别移植到第三组年轻小鼠体内。结果显示,来自年长小鼠的APCs能迅速扩张并制造大量新的脂肪细胞,而年轻小鼠的APCs则几乎没有相同的表现。这说明年龄较大的APCs自身具有更强的脂肪生成能力,且这种能力并不依赖宿主的年龄环境。接着,研究者利用单细胞RNA测序技术,对年轻和中年小鼠的APCs基因表达进行了比较。令科学家意外的是,在年轻小鼠中这些细胞活动极低,而在中年小鼠中,这些APCs被激活,展现出极强的分化潜能,开始疯狂生成新的脂肪细胞。这种“激活”状态打破了传统认知。
通常,我们认为随着年龄增长,大多数组织干细胞的活性会逐渐下降,修复功能减弱,然而APCs却反其道而行,在中年反而进入了“过载”状态。这一发现首次揭示了腰围中年增大的细胞学根源。研究还发现,年龄的增长不仅激活了APCs,它们还转化成了一种新型干细胞,称为“专一型前脂肪细胞”(committed preadipocytes,CP-As)。这些CP-As细胞是在中年阶段出现,专门致力于高效制造脂肪细胞,直接导致腹部脂肪显著增加。而在这个转变过程中,体内的信号通路“白血病抑制因子受体”(LIFR)扮演关键角色。年轻小鼠脂肪生成不依赖LIFR信号,但中年小鼠则依赖这一信号促进CP-As细胞繁殖与分化。
研究人员由此推断,LIFR信号的激活是中年脂肪生成的“开关”,它激发APCs转化和脂肪细胞大量生成。为了验证这些发现,团队还对来自不同年龄段的人体脂肪组织样本进行了单细胞RNA测序分析。结果发现类似的CP-As细胞在中年人体组织中数量明显增加,且它们同样具备高效脂肪制造能力。这一跨物种的一致性使研究结果更具说服力,也为人类肥胖预防方案提供了方向。研究显示,中年腰围扩大的过程并非单纯因饮食过量或运动不足,而更多是干细胞功能“异常活跃”导致脂肪生成过快。这一发现具有重要意义。
腹部内脏脂肪不仅影响外观,更与多种代谢疾病密切相关,如2型糖尿病、心血管疾病和慢性炎症等。腰腹部肥胖加速身体衰老,降低代谢效率,因而控制脂肪细胞的新生成成为延缓这些疾病风险的关键。未来医学研究或将以阻断LIFR信号路径或靶向CP-As细胞为突破口,开发全新治疗手段帮助中年人群控制腹部脂肪堆积,促进健康寿命延长。此外,这一发现也挑战了我们对于干细胞老化的传统理解。干细胞状态的改变并非一味衰退,而是细胞命运的重新编程,这提供了更广泛的生物学启示。除了脂肪生成,诸如肌肉萎缩、骨质疏松等老年性变化也许背后存在类似机制。
了解干细胞在不同组织中的年龄相关变化,将有助于构建全方位的抗衰老策略。日常生活中,虽然无法完全避免干细胞的自然老化过程,但健康饮食、适度运动和良好心理状态仍然是维持脂肪代谢平衡的重要保障。此外,定期体检和关注自身腰围趋势,对预防相关慢性疾病也至关重要。随着科学的不断推进,未来可能通过药物或基因疗法调节APCs和CP-As的活性,从根本上延缓腹部脂肪的异常扩增,为中年人群提供更有效的健康管理方案。此次来自City of Hope和UCLA的合作研究,发表于知名学术期刊《Science》,标志着脂肪生成和肥胖机理研究的一大突破。研究不仅揭示了中年腰围扩大的分子细胞基础,也为全球应对肥胖与代谢疾病的挑战带来了新的科学武器。
综上所述,中年腰围变宽并非不可避免的自然现象,而是体内老化干细胞改变所致的复杂过程。理解这一机制,有助于促使我们采取更科学、有效的应对措施,守护健康,远离脂肪堆积带来的多重健康威胁。未来,随着相关治疗手段的研发成熟,我们有望从根本上破解中年肥胖之谜,推动个体健康与寿命双向提升。