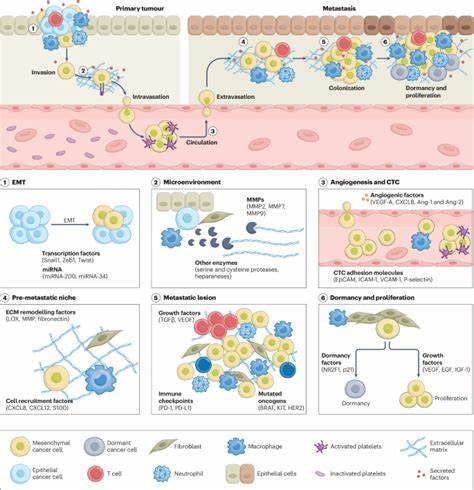
癌症的最致命阶段往往不是原发肿瘤本身,而是癌细胞通过转移扩散到身体其他部位形成新的肿瘤灶。转移过程复杂且难以治愈,传统治疗方式对转移病灶的控制能力有限,致使患者的预后依然不理想。近年来,随着纳米技术的快速发展,纳米医药在癌症治疗领域展现出革命性的前景,尤其在针对癌症转移的治疗上提供了新的突破口。纳米医药利用纳米级别载体实现药物的精准递送,能够有效克服传统化疗的多重挑战,为转移性癌症治疗带来全新的可能性。癌症转移涉及多个阶段,包括肿瘤细胞的局部侵袭、进入血液循环、在血液中存活、在新部位外逸及最终形成新的肿瘤微环境。每一个步骤都对治疗提出了特殊的挑战。
纳米医药能够针对这些不同阶段设计功能化的纳米载体,实现药物的精准释放和作用,提高转移病灶的药物浓度和疗效。传统癌症治疗多聚焦于阻断肿瘤生长,忽视了转移机制及其微环境的复杂性。相比之下,纳米医药能够携带多功能分子,如靶向配体、抗体和调控RNA,精准识别并作用于转移相关的信号通路。通过调节肿瘤微环境内的细胞和基质成分,纳米药物不仅抑制肿瘤细胞的扩散,还能逆转免疫抑制状态,促进免疫细胞活性,从而形成多维度抗转移网络。纳米载体的高度可设计性使其成为理想的药物传输工具。被动靶向策略基于增强渗透和滞留效应,利用转移灶肿瘤部位血管异常的特性实现药物富集。
主动靶向则结合纳米载体表面的特异性配体,识别癌细胞特有的表面标志物,提升药物的细胞内吸收率。除了传统药物,核酸类治疗如siRNA和miRNA也通过纳米载体实现高效传递,有效沉默促转移基因,阻断分子通路,遏制转移进程。刺激响应型纳米系统进一步提升了治疗的精准性和安全性。基于肿瘤微环境的PH值、酶活性或光热特性,纳米载体可以实现智能药物释放,在转移灶局部释放高浓度药物,并减少对正常组织的损伤。例如,基于基质金属蛋白酶响应的纳米药物系统能够特异性降解肿瘤基质,从而促进药物穿透,提高治疗深度和广度。多药物联合治疗是应对转移性癌症耐药及多样性的重要策略。
纳米平台能够将不同机制的药物组合封装,在合适的时间和空间释放,实现协同抗癌效果。同时,纳米载体还兼具免疫调节功能,联动化学治疗与免疫治疗。肿瘤免疫微环境对转移起着关键作用,纳米医药通过递送肿瘤抗原、免疫激活剂或检查点抑制剂,有效激发机体免疫识别并清除转移细胞。为推动纳米医药向临床转化,研究者建立了多种体外与体内转移模型,涵盖从三维肿瘤球、器官芯片到转基因小鼠和斑马鱼模型。这些模型帮助解析纳米药物的递送机制及其对转移过程的干预效果,优化设计参数,提高治疗的预测准确性和安全性。此外,患者异质性及转移部位的多样性也对治疗提出了个性化要求。
纳米医药的发展逐渐重视基于患者特征的精准医疗,利用基因组学和影像学手段进行分层,制定针对性的纳米药物方案,提升治疗效率和临床获益。目前已有数款抗转移的纳米医药获批上市,如用于乳腺癌和肺癌转移治疗的脂质体药物和聚合物载体系统,展示了优异的疗效和耐受性。临床试验中,多种创新的纳米治疗方案也正被验证其安全性和疗效,涵盖了从核酸治疗到光热联合免疫治疗的多模态组合。尽管取得了显著进展,纳米医药在转移癌症治疗仍面临一些挑战。诸如纳米载体在体内的分布和清除机制复杂,可能引发免疫反应和毒副作用。此外,肿瘤微环境的异质性及动态变化,影响了纳米药物的靶向效率和持续疗效。
因此,深入理解肿瘤生物学、优化纳米材料生物相容性及设计智能响应系统,是未来研究的重点。展望未来,纳米医药有望与人工智能、大数据分析和基因编辑等前沿技术结合,推动转移性癌症治疗的个性化和智能化。通过多学科交叉,构建从诊断到治疗的一体化纳米平台,实现早期发现、精准干预及疗效监控。此外,纳米技术在开发新型免疫疗法、调控肿瘤代谢及逆转耐药机制等方面,也将持续释放巨大的潜力。总体而言,纳米医药正引领着癌症转移治疗的新革命。它不仅为攻克转移性癌症带来希望,更为医疗技术创新树立了崭新的典范。
在科学研究和临床实践的共同推动下,未来纳米技术将成为治愈晚期癌症的重要助力,极大改善患者生活质量和生存预期。随着相关技术不断成熟和法规环境的完善,纳米医药势必在抗击癌症转移的战役中发挥关键作用,成为现代精准肿瘤医学的重要里程碑。 。