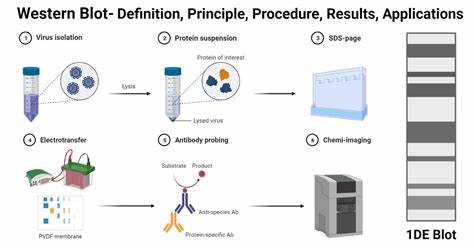
Western Blot技术,又称免疫印迹法,是生命科学领域中广泛应用的一种强有力的分析手段,主要用于从复杂的蛋白混合物中精确识别特定蛋白质,并对其表达水平进行定量评估。该方法结合了凝胶电泳的分离能力和抗体的高度特异性,能够揭示蛋白质的分子量、丰度及修饰状态。熟练掌握Western Blot实验技术对科研人员深入理解生物过程和疾病机制至关重要。Western Blot实验包含多个关键步骤,通过科学合理的流程设计和细致严谨的操作,可获得准确而可靠的结果。实验从样品制备开始,科学地裂解细胞或组织获取蛋白质,确保蛋白质的完整性及其代表性。裂解缓冲液通常包括SDS或Triton X-100等去污剂,能够有效破坏细胞膜并溶解蛋白,同时添加蛋白酶和磷酸酶抑制剂以防止蛋白降解和不良修饰。
蛋白定量是后续分析的基础,广泛采用的Bradford法和BCA法能准确测定总蛋白量,保证样品间蛋白加载量均一,避免定量误差。随后通过SDS-PAGE进行蛋白质的电泳分离。首先将蛋白样品与含有SDS和还原剂(如DTT或β-巯基乙醇)的加载缓冲液混合加热,使蛋白质完全变性,SDS赋予蛋白均一的负电荷,去除蛋白的天然构象和电荷差异,还原剂断开二硫键,确保蛋白线性结构。电泳过程中,蛋白受电场驱动穿过聚丙烯酰胺凝胶,依据分子量大小实现有效分离,小分子蛋白迁移速度更快更远。电泳完成后,必须将蛋白从凝胶转移到更坚固的支持膜上,常用的膜材料包括硝酸纤维素(Nitrocellulose)和聚偏二氟乙烯(PVDF)。这一转膜步骤为抗体探测蛋白质提供了便捷平台。
转膜方式主要有湿转和半干转两种。湿转法传统且通用,适合大分子蛋白及高要求定量分析,虽需较多转移缓冲液和时间,但能保证转印效率并减少热损伤。半干转法则以快速方便著称,耗液少,转膜时间短,适用于中小分子蛋白的常规检测,但大蛋白转印效率相对较低,需谨防缓冲溶液不足导致膜板干涸。完成转膜后,需阻断膜上非特异性结合位点,以防止抗体的非特异性结合造成背景信号。封闭液通常包含3%至5%的牛血清白蛋白(BSA)或脱脂奶粉溶于含Tween-20的缓冲液中,例如TBST或PBST,借助这些蛋白质填充膜上的空白位置,显著降低抗体与膜基质的非特异结合。抗体孵育是Western Blot中极为关键的步骤。
首先加入一抗,即特异识别目标蛋白的抗体,它直接结合目标蛋白。孵育时间视抗体质量和实验需求可在室温几小时至4摄氏度过夜。随后通过多次洗涤彻底清除未结合的一抗,减少背景干扰。其次加入二抗,即识别一抗种属的抗体,通常带有酶标(如辣根过氧化物酶,HRP)或荧光团,用以放大信号并实现检测。二抗孵育后再次洗涤,确保仅保留特异性结合的抗体复合物。Western Blot的检测手段丰富多样。
目前最常用的检测方法包括化学发光检测、荧光检测和比色检测。化学发光检测是基于HRP催化底物发光的原理,灵敏度极高,可检测皮克克至飞克克量级的蛋白。通过专业的成像设备捕获信号,便于数字化分析和精确定量,但信号具有时间限制,需快速成像。荧光检测则利用带有稳定荧光染料的二抗,在特定激发光源下发出特定波长的光,信号相对稳定,支持多重标记同一膜,便于内参蛋白与目标蛋白同步检测,提高分析可靠性。缺点为设备成本较高,以及膜可能出现自体荧光影响信噪比。比色检测利用带酶标的二抗与染色底物反应,形成肉眼可见的颜色沉淀,操作简单无需复杂仪器,但灵敏度相对较低,定量分析受限。
通过合适的检测方法,研究者可以准确判定目的蛋白是否表达及其表达量,结合内参蛋白如GAPDH或β-actin等,实现半定量甚至绝对定量分析。实验数据通常借助专用软件进行条带灰度分析和密度测量,比较不同样品间蛋白差异。为保障实验可靠性,选择经过严格验证的抗体和设立足够的对照极为重要。包括加载对照(保证样品蛋白量一致)、阳性对照(确认检测系统有效)以及阴性对照(排除非特异性信号)等。此外,优化封闭液类型、抗体浓度及孵育时间是提高信噪比和结果稳定性的关键。Western Blot虽然是技术成熟的蛋白检测方法,但在操作过程中仍可能遇到背景高、条带弱、非特异性条带等问题,需结合实验条件和数据反馈不断细化优化方案。
总之,Western Blot是揭示蛋白质表达与修饰的重要利器,掌握其原理和标准化操作流程,有助于科学家们准确、灵敏且高效地展开蛋白组学研究及疾病机制探索。随着新型转膜技术和多重检测手段的不断发展,Western Blot将在现代生物医学研究中发挥更加显著的作用和价值。