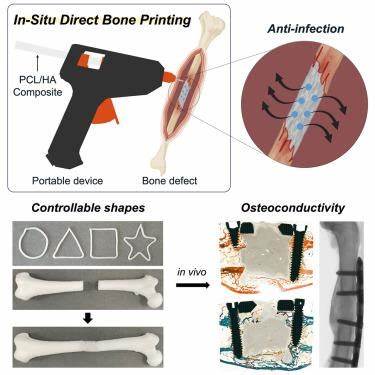
为什么需要原位打印可降解骨植入物? 大型临界尺寸骨缺损是外伤、肿瘤切除或复杂骨折后的难治问题,传统治疗依赖自体或异体骨移植、金属内固定或骨水泥填充,均存在供区损伤、免疫排斥、长期并发症或与周围组织不匹配等缺点。随着3D打印和组织工程的发展,个性化可降解支架被视为未来方向,但常规3D打印流程需要术前扫描、数字建模、打印与灭菌等多个环节,耗时且不易在手术室即时调整。原位打印(in situ printing)通过在缺损现场直接挤出成形植入物,跳过繁琐预制流程,实现与缺损形状和周围软硬组织的高度贴合,显著提高临床灵活性与效率。 核心材料与工艺要点 成功的原位打印植入物需满足生物相容、可降解、力学支持与易操作等多个条件。聚己内酯(PCL)因其低熔点、良好生物相容性和可控降解性成为常用高分子基体。向PCL中掺入羟基磷灰石(HA)等钙磷陶瓷能增强骨导性和力学强度,并提供骨矿化的无机成分模拟。
热熔挤出法(hot-melt extrusion)利用高分子低温熔融,避免有机溶剂残留,适合现场手持设备实现即时打印。便携式设备通常改造自热熔胶枪,配备温控模块以控制喷嘴温度,确保材料可流动且不至于对周围组织造成热损伤。 温控与现场安全性 PCL在60℃附近熔融,而传统热熔工具温度往往更高。为实现生物组织友好的现场打印,设备需具备准确温控和快速冷却特性。采用正温度系数(PTC)陶瓷加热元件或电子恒温控制器可将打印温度限定在一个安全窗口内,并缩短植入物表面冷却至体温的时间,以避免热损伤和周围组织坏死。不同分子量的PCL与不同比例的HA对熔融温度和黏度有影响,需在配方设计阶段优化,以兼顾挤出流动性、成形精度与力学性能。
力学性能与组织粘附 骨替代植入物必须在早期提供机械支持并随着组织修复逐步降解。PCL分子量和HA含量是调控压缩强度、弯曲刚度和粘附力的关键。高分子量PCL可提升抗压与抗弯性能,而增加HA能进一步强化刚性。然而,过多的HA会导致熔体黏度升高、打印困难以及界面粘附下降。因此,配方通常在兼顾可挤出性的前提下,选取中高分子量PCL并限制HA在一定比例内,以保证植入后与骨床的稳定粘结。对于承重部位或大尺寸缺损,可能需要与传统内固定(如钢板、螺钉)联合使用,或引入复合高分子以提高初期力学稳定性。
降解行为与骨重建节律 可降解植入物的降解速率要与骨再生节律匹配。PCL在体内的酯键水解和酶促降解速度较慢,从数月到数年不等,分子量、几何尺寸以及陶瓷填料都会影响速率。HA的加入常常延缓降解并保持植入体结构稳定,从而在修复早期提供持久支撑,同时为细胞矿化提供钙磷环境。通过调节PCL分子量、填料类型和孔隙结构,或引入更易降解的共聚物,可以实现降解时间窗口的个性化设计,满足不同部位和患者的愈合需求。 抗感染策略:植入物与药物释放 术后感染是骨植入失败的主要风险之一。向可降解植入物中负载抗生素能够在局部实现高药物浓度、减少系统毒性并降低感染率。
常见抗生素如万古霉素和庆大霉素分别对革兰氏阳性和革兰氏阴性菌有效,将其混入PCL/HA基体后可通过扩散和材料降解持续释放。药物分子量、载量、HA含量及植入物孔隙度共同决定释放曲线。一般而言,分子量较小的药物扩散更快,亲水性的HA有助于药物溶出并加速释放。合理设计释放动力学能够在关键窗口期提供足够抑菌浓度,从而降低感染风险并保障骨愈合。 细胞相容性与骨诱导潜力 理想的骨替代材料不仅是机械支撑体,更应主动促进骨形成。HA表面的羟基和磷酸盐基团能促进成骨细胞黏附、增殖及向成骨系分化,并增强矿化能力。
在体外实验中,将间充质干细胞或成骨前体细胞置于PCL/HA支架上,常观察到细胞良好的粘附和生长,以及随着HA含量增加而提高的成骨基因表达和钙化结节形成。植入物的微观表面结构、粗糙度和孔隙互通性也显著影响细胞迁移与血管化,进而决定修复质量。 体内验证与模型选择 任何新型植入物都需在动物模型中进行系统评价。常见的体内试验包括兔或大动物的关键尺寸长骨缺损模型,用以模拟临床中的非愈合骨缺损。通过微CT、组织学染色和力学测试可以评估新骨形成、植入物降解和功能恢复。研究显示,PCL/HA原位打印植入物在兔股骨关键尺寸缺损中能够填充缺损、促进新骨形成并改善骨量和骨面等指标,与不可降解骨水泥相比展示出更好的骨组织整合与组织重建趋势。
临床可行性与手术流程整合 原位打印技术的临床推广需要考虑手术室环境、无菌流程、器械便携性与外科医生的操作习惯。便携式热熔挤出设备应支持低温恒定输出、易于灭菌且电源兼容手术室条件。材料需要预先制成可装载的无菌棒状或颗粒形式,并在术中由外科医生或术中设备完成加热、挤出与定型。为确保初期机械稳定性和骨愈合,临床使用中可能仍需搭配内固定器械,或在有感染风险的情况下优先采取包含抗菌药物释放的配方。 监管、灭菌与质量控制 医疗植入物的监管要求严格,尤其是直接应用于人体的可降解材料。生产过程需符合医疗器械质量管理体系,材料成分与制造参数应建立可追溯的工艺文件。
由于热熔工艺可在现场完成,保证植入材料在装载前的无菌性尤为关键。低温等离子体灭菌或过氧化氢低温灭菌可以在保护材料性能的同时实现有效灭菌,但不同灭菌方式对高分子和药物载体的稳定性有不同影响,需在开发阶段验证。药物加载植入物同时涉及药品和器械双重监管,审批过程更为复杂。 潜在局限与改进方向 原位打印可降解植入物技术尚处发展阶段,仍面临若干挑战。第一,材料和设备需进一步优化以提升打印精度和表面微结构控制,从而促进血管化与细胞入侵。第二,长期降解产物的生物安全性、慢性炎症反应与免疫学效应需更多大动物和长期随访数据支撑。
第三,针对承重骨段的临床应用需增强初期力学性能,可能通过复合材料或预制金属支架-聚合物复合体来实现。第四,个性化修复涉及术中影像配套、实时三维采集与建模技术,与手术流程的整合需跨学科协作。 未来展望与临床意义 原位打印可降解植入物为解决复杂骨缺损提供了一条具有临床应用潜力的新路径。它将个性化制造直接带入手术现场,实现按需成形、即时调节和药物联合治疗。未来结合术中三维成像、机器人辅助手术和可生物活性材料,原位打印植入物有望在创伤骨科、肿瘤切除后重建和感染高风险病例中发挥重要作用。随着材料科学、智能制造与临床验证的推进,这一技术有望转化为安全、高效的临床方案,提升患者功能恢复与生活质量。
对研究者与临床医生的建议 在开展相关研究或临床试用前,应从材料配方、力学评估、药物释放动力学、体外细胞学验证到动物长期随访逐步推进。多学科团队包括材料科学家、临床骨科医生、生物工程师与监管专家的协作将显著提高研究质量和转化效率。术中操作需制定标准化流程,保证灭菌、温控和打印质量。临床试验设计应关注安全性、感染率、骨愈合质量和功能恢复等关键终点,以便为监管审批与临床实践提供证据支持。 结语 原位打印可降解骨植入物将个性化制造与现场成形结合,为治疗关键尺寸骨缺损提供新的策略。通过合理选择聚合物基体、陶瓷填料与药物负载,配合低温热熔挤出设备与严谨的质量控制,能够在提高修复效果的同时降低并发症风险。
尽管仍需克服力学、降解匹配与长期安全性等挑战,跨学科协作与系统化临床验证将推动该技术走向成熟并惠及更多患者。 。