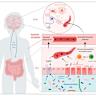
社交焦虑症,也称社交恐惧症,是一种以在社交场合中体验到强烈恐惧和焦虑为特征的精神障碍。受此影响的个体往往会回避社交活动,严重时可能导致生活质量大幅下降。尽管这种障碍广泛存在,但其生物学基础尚不完全明朗,限制了针对性的治疗策略的开发。最近,科学界对肠道微生物群与中枢神经系统之间的联系产生了浓厚兴趣,尤其是在调节行为和情绪健康方面。肠脑轴这一复杂的双向信号传导系统揭示了肠道微生物在神经发展、免疫调节及神经信号传递中的关键作用。肠道微生物群的组成和多样性直接关联多种神经精神疾病,包括抑郁症、焦虑症和自闭症谱系障碍。
最新研究通过移植社交焦虑症(SAD)患者的肠道菌群到无菌小鼠模型,发现受体动物表现出特定的社交恐惧增加,这一发现首次从因果关系层面证实了肠道微生物对社交行为影响的直接作用。更重要的是,当小鼠接受来自健康对照组的肠道菌群移植时,并未表现出相同程度的社交恐惧,说明肠道微生物群的异常与社交焦虑之间存在明确联系。肠道微生物通过多种机制影响宿主的社会行为。首先,肠道内微生物代谢产物如短链脂肪酸可以穿过肠壁进入血液循环,进而影响大脑的神经递质平衡和神经炎症水平。其次,免疫系统的变化也是关键的介导路径。研究显示,接受SAD患者菌群移植的小鼠在中枢及外围免疫系统中均表现出活性增强,提示免疫激活可能是社交恐惧增强的驱动力之一。
再者,激素和神经肽如催产素在调控社交行为中占据核心地位。重要发现之一是社交焦虑相关的肠道菌群使小鼠床核(大脑边缘系统的一部分,负责应激和情绪调节)中的催产素表达异常,这可能直接导致社会恐惧情绪的加剧。催产素被广泛认为是“社交激素”,任何其功能失调都会显著影响个体的社交能力。因此,肠道微生物通过影响催产素信号通路,调节社会恐惧反应,为理解社交焦虑症的生物学机制提供了全新视角。探索肠道微生物调节社交行为的研究还打开了治疗社交焦虑症的新窗口。传统方法如认知行为疗法和药物治疗在一定程度上缓解症状,但副作用和疗效有限。
通过调整肠道微生物群的组成,或许可以通过改善免疫状态和神经激素平衡,达到减轻社交恐惧的目的。益生菌、益生元及饮食干预有望成为未来精准化的辅助治疗方案。如何科学合理地操作肠道菌群也成为研究热点。未来临床应用前需明确哪类菌株和哪些微生物群落组合能够有效缓解社交焦虑的症状,同时保证安全性和长期稳定性。社交焦虑症患者的肠道菌群结构与健康人存在显著差异,表明疾病本身可能导致微生物环境改变,或反映病理状态的分子标志。这一现象引发了对因果关系的进一步探讨:肠道失衡是否为社交焦虑症的诱因之一,还是其表现的结果?目前而言,动物模型移植实验为肠道微生物在社交行为调控中的作用提供了有力证明,但在人体中的应用和机制解读仍需深入研究。
社会功能障碍是社交焦虑症最典型的表现之一,影响患者的职业、人际关系和心理健康,甚至加重其他精神疾病的风险。了解肠道微生物如何影响大脑的神经网络及免疫系统,可帮助科研人员设计更具针对性的早期干预和预防措施。此外,肠道微生物的检测也有望成为社交焦虑症早期诊断和个体化治疗方案制定的重要工具。随着脑-肠轴研究的深入推广,跨学科的研究模式正逐渐形成,包括神经科学、微生物学、免疫学和精神病学之间的协同合作,为复杂精神疾病的理解与治疗提供了新动力。社会恐惧的诱发机制复杂多样,环境因素如压力、遗传背景及早期生活经历与生物学因素相互交织。肠道微生物作为调节者,不仅在生物学层面为疾病的发展提供基础,也反映了个体与环境相互作用的独特印记。
总结来看,肠道微生物群在社交焦虑症中的作用日益受到关注。通过动物模型的移植实验,科学家揭示了特定肠道菌群能够增强社交恐惧的能力,伴随着免疫和神经激素的显著变化。未来,围绕肠道微生物的精准干预有望成为治疗和管理社交焦虑症的创新途径。持续开展肠脑轴的基础和临床研究,将为数百万受社交焦虑症困扰的人们带来新的希望和福音。