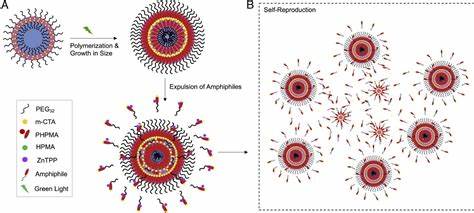
生命的核心特征之一是自我复制,即有机体能够基于自身的物质和能量,实现自身的繁殖和后代的诞生。传统上,科学界普遍认为高度复杂的生物化学过程是实现生命自我复制的基础。然而,来自哈佛大学的一项最新研究颠覆了这一认知,证明了非生化系统也能完成模拟生物细胞的自我复制行为,开启了合成生命科学的新纪元。这项研究中,科学家们设计了一种非生化的化学反应体系,能够在无生命的条件下形成类似细胞的聚合物囊泡结构,并使其实现自我繁殖,释放出名为“聚合物孢子”的新型结构,进而以指数增长方式扩展其群体规模。该研究成果于2025年发表在《美国科学院院刊》(PNAS)上,标志着人工合成细胞研究上的重要突破。科学家们利用光敏催化机制,在含有水溶性聚合物、疏水性链转移剂、单体和光催化剂的混合物中启动光诱导的可逆加成-断裂链转移(RAFT)光聚合反应。
混合物在绿光(530纳米波长)照射下约90分钟,使得起始分子转变成双亲性嵌段共聚物,这些共聚物自发组装成囊泡结构。更令人惊讶的是,囊泡不仅能稳定存在,还能通过释放聚合物“孢子”实现自身复制。释放出的孢子在体系中重新组织,形成新一代囊泡,继而完成类似生命体的繁殖循环。这种机制模拟了生物细胞世代传承特性,使得人工合成细胞显示出类似自然生命的繁殖行为。此前,尽管有研究报道了合成聚合物体系中存在类似复制的行为,如聚合诱导自组装(PISA)过程,但这些体系通常依赖生化成分或无法实现真正自主的复制过程。因此,本研究通过纯粹非生化的化学体系,展示了完全脱离传统生物链条的自主复制,实现了实验室中“生命-like”系统的合成。
该成果不仅为生命起源的科学探索提供了重要线索,也为人工合成生命体和生命模拟提供了强有力的实验平台。通过理解分子如何仅凭简单化学互动产生复杂的自组织和繁殖行为,研究者们得以接近揭示生命从无机化学过渡到有机生命的关键步骤。此外,这种非生化的合成细胞结构未来可能在多领域展现广泛潜力。在药物传递系统中,自复制囊泡可以实现高效载体的规模放大和自我更新,提升治疗效果和稳定性。在环境监测或仿生传感器领域,人工囊泡能够模拟细胞感受和响应外界刺激,为智能响应材料设计提供创新路径。在合成生物学和材料科学领域,这类动力学活跃且自主复制的非生化结构为构建新型功能材料奠定了基础。
该研究凸显了光催化驱动的RAFT聚合技术在制备双亲性聚合物和自组装结构方面的优势,为构建可控的人工细胞提供了通用策略。通过精准调整反应条件、分子设计和光谱参数,将进一步推动人工细胞功能的多样化和复杂度提升。科学界在此基础上也开始关注如何将更多生物功能如代谢模拟、环境响应性引入到非生化人工细胞系统,朝向更接近生物生命体的复杂人工生命形态迈进。哈佛团队的成功不仅丰富了生命科学和化学的交叉研究,还激发了新一轮关于生命本质和起源的哲学思考。自维尔乔(Rudolf Virchow)提出“所有细胞来自细胞”以来,生命的连续性被看作自然法则。然而,若非生化体系亦可展现自我复制,生命的定义与边界或将被重新审视。
未来,随着实验技术不断进步和理论模型的完善,人工合成细胞研究有望助力实现人工生命、合成生态系统乃至新型智能材料的开发。这无疑将推动生物医药、环境科技、纳米技术等多个前沿领域的革命。简而言之,本研究突破了传统生物复制的生化束缚,赋予人工聚合物体系生命般的繁殖特性,为揭示生命起源机制和构建新型智能系统提供了强力支撑。期待随着这股科研热潮不断升温,更多创新成果将在合成生物学和材料科学领域催生,为未来的科技发展拓展无限可能。