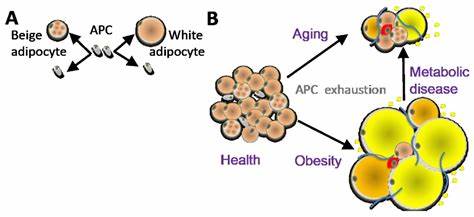
随着现代生活节奏的加快以及人口老龄化进程的加深,脂肪组织的变化及其对人体健康的影响,已经成为医学和健康领域研究的热点。脂肪不仅是能量储存的场所,还参与调节内分泌与代谢,维持全身稳态。然而,年龄增长带来的脂肪组织积累,特别是内脏脂肪的异常增加,成为与肥胖、糖尿病、心血管疾病等代谢疾病密切相关的重要因素。近期,科学家们在脂肪前体细胞的研究中发现了一种随着年龄出现的独特细胞群体,具有促使脂肪生成(脂肪细胞形成)的活跃功能,为深入理解年龄相关脂肪组织变化及代谢疾病的基础机制提供了突破口。 脂肪组织的扩展主要通过两种方式实现:脂肪细胞的体积扩大(肥大)和新的脂肪细胞生成(脂肪细胞生成,或称脂肪生成)。而脂肪生成是指脂肪前体细胞的增殖和分化过程。
传统观点认为,随着年龄增长,人体脂肪前体细胞的功能逐渐减退,脂肪生成能力下降。然而,通过对中年小鼠及人体内脏脂肪的细胞追踪和单细胞转录组测序,研究者发现了一种年龄特异性的脂肪细胞祖细胞——承诺型前脂肪细胞(简称CP-A),这一细胞群在中年阶段显著增多,表现出较高的增殖和分化能力,明显区别于年轻时脂肪前体细胞的低活性状态。 深入研究表明,CP-A细胞的增殖和脂肪生成依赖于白血病抑制因子受体(LIFR)信号通路的激活。实验中,通过药物抑制或基因操控阻断LIFR信号,发现CP-A细胞的脂肪生成过程被明显抑制,而普通年轻脂肪前体细胞的脂肪生成不受影响,这意味着LIFR是中年特异性的脂肪生成调控因子。更重要的是,在早期老龄阶段,通过长期使用LIFR抑制剂,可以有效阻止内脏脂肪的异常扩张,为未来临床防治年龄相关肥胖及代谢疾病提供了潜在治疗靶点。 这些发现打破了传统认知,即年龄增长必然导致脂肪前体细胞功能减退的观点。
相反,中年阶段的脂肪前体细胞出现了一种逆转趋势的亚群体,主动参与脂肪组织的重塑和扩展。这种年龄相关的细胞特征具有时间、部位及性别的特异性,主要集中在男性的内脏脂肪区域,并在中年时达到峰值,随着更年期和晚期老龄又开始减少,提示脂肪组织的动态变化与整体人体代谢状态密切相关。 此外,研究团队利用先进的三维细胞培养体系和体内移植实验,结合单细胞RNA测序技术,系统分析了脂肪组织各类前体细胞的谱系动态和分子特征。结果显示,中年CP-A细胞在转录水平上展现出主动分化信号增强和增殖相关基因高表达,同时伴随着特定细胞表面标志分子的受体基因(如LIFR)显著上调,具备较强的脂肪形成潜能。该细胞类型不仅在小鼠模型中被确认,在人体内脏脂肪组织中也有类似的细胞群体,显示出在临床转化中的广泛意义。 研究还分析了中年脂肪新增对代谢功能的影响。
随着CP-A细胞主导的脂肪生成过程增强,中年男性小鼠表现出脂肪细胞体积减小(脂肪细胞假小化),内脏脂肪明显积累,伴随能量消耗降低、胰岛素抵抗等代谢异常。这些变化与人类中年后肥胖伴发的代谢综合征密切相关,说明CP-A细胞的过度活跃可能是加速中年代谢风险的细胞基础。 此外,分子水平的探讨揭示,LIFR作为一个gp130受体家族成员,通过特异性信号传导,调控CP-A细胞的基因表达和脂肪生成路径。这一机制不仅调节细胞命运选择,而且为精准干预脂肪组织的年龄相关病理变化提供了可能路径。当前中年年龄群的体重管理和代谢健康维护面临巨大挑战,针对LIFR及CP-A细胞的干预措施,有望实现对中年脂肪堆积及代谢紊乱的预防和治疗。 值得关注的是,脂肪组织的增殖与传统成年干细胞功能普遍衰减趋势形成鲜明对比。
在绝大多数成体组织中,干细胞随着年龄增长表现出再生能力下降,但脂肪前体细胞在中年异常激活形成新脂肪细胞,为后续代谢适应或失衡造成了细胞学基础。是否该阶段脂肪组织调节失控会增加疾病风险,仍需进一步深入研究。 综上,随着年龄的增长,尤其在中年阶段,一类独特的脂肪祖细胞——承诺型前脂肪细胞通过LIFR信号的调控,激活了脂肪生成过程,推动了内脏脂肪堆积及代谢功能改变。该发现丰富了脂肪组织生物学和老龄化研究领域的知识体系,为改善中年后代谢健康提供了新的思路和治疗靶点。未来研究需进一步揭示CP-A细胞调控网络、其与代谢通路和免疫环境的复杂交互,并探索如何通过生活方式或药物干预调节脂肪组织的这种年龄相关变化,为健康老龄化贡献力量。