噬菌体作为地球上数量最为丰富的生物实体,蕴藏着庞大的遗传多样性及复杂的分子机制,成为现代微生物学与基因组学研究的热点。然而,噬菌体的基因功能鉴定始终面临巨大挑战,主要由于多数噬菌体及其宿主缺乏遗传操作的便利性。随着生物技术的进步,可编程反义寡核苷酸(Antisense Oligomers, ASOs)技术崭露头角,表现出强大的潜力,成为破解噬菌体功能谜团的新利器。首先,ASOs通过靶向噬菌体mRNA的翻译起始区域,阻断相关蛋白的合成,实现对噬菌体基因表达的精准调控。这种非遗传学的调控手段,不仅规避了传统基因编辑技术在噬菌体研究中的限制,而且能够在多样且基因操作困难的噬菌体-宿主系统中灵活应用。研究显示,ASOs结合细胞穿透肽(Cell-Penetrating Peptides, CPPs)被高效输送至细菌细胞内,成功实现了对多种DNA及RNA噬菌体关键基因的有效沉默,为探究噬菌体生物学机理和识别必需基因提供了全新策略。
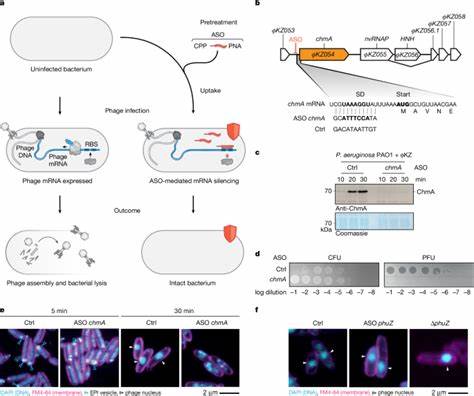
噬菌体ΦKZ的研究为ASO技术应用的典范。ΦKZ属巨型噬菌体,拥有复杂的感染周期和细胞内核构造,其基因组庞大且难以通过传统基因组编辑技术进行深入研究。通过设计针对核心核壳蛋白chmA的特异性ASOs,科学家实现了阻断噬菌体核形成和复制周期的目的,极大地验证了ASO的功能沉默效力。同时,该方法不仅使获得细胞存活的只感染未能扩增噬菌体的状态成为可能,还显著削弱甚至消除噬菌体复制的生物学指标,如斑点形成与噬菌体粒子数量。这种基于ASO的基因沉默手段还能够精准模拟基因敲除效应,重现如phuZ基因缺失引起的细胞内噬菌体核不定位现象,展示了高特异性与高度还原性的特质。技术上,ASO设计辅以智能算法预测,如MASON算法,综合考虑目标mRNA的热稳定性、避免错配靶向及自身二级结构等因素,从而提升ASO的特异性和效率。
实验数据表明在翻译起始区附近多点设计的ASOs均可诱导强效的基因沉默,减少假阳性风险。进一步的蛋白质组学与转录组学分析表明,ASO的脱靶效应极低,能够选择性地降低特定靶蛋白的表达而不显著扰动宿主及噬菌体其它蛋白质表达网络,确保实验的可信度与准确性。多维度分析还发现,ASO介导的基因沉默不仅在传统模型菌株中表现出色,同时在临床分离株及其他噬菌体-宿主组合中也具备广泛适用性。无论是针对基因遗传难以改造的临床菌株,还是DNA或RNA噬菌体,不同种类的ASO均表现出了强效的抗噬菌体活性,以及功能基因筛查能力。此外,ASO能够针对宿主抗噬菌体防御机制关键基因进行打击,提升噬菌体对抗临床菌株的感染效率,展现出潜在辅助噬菌体疗法的应用前景。综合高通量筛选结果,ASO技术实现了对噬菌体基因组中多个未知功能基因的功能性注释,为识别必需基因及调控节点提供了系统性视角。
筛选中,即使是低丰度或晚期表达的基因,也因ASO介入而展现出生物学表型或分子事件的改变。结合RNA测序,可以观察到基因沉默后噬菌体与宿主转录组的变化模式,细化病毒生命周期中关键信息传递及应答机制阐释。而在功能验证层面,核心基因ΦKZ155作为RNase H样核酸酶,虽具核酸识别结构,但其必需性并不完全依赖其酶活性,反映出可能具有感应或调控染色体复制的结构功能。ASO介导的基因沉默配合质粒补充表达,成功实现对该基因的功能恢复,提供了破解复杂蛋白多功能性的实验策略。结合精细的细胞成像和基因组扩增分析,ΦKZ155被认定在噬菌体核成熟和基因组复制启动中占据关键地位。该发现为揭示噬菌体感染空间组织和时间协调机制,以及噬菌体与宿主分子互作提供了深刻见解。
展望未来,ASOs技术还能够应用于小非编码RNA的功能解读,探索病毒及宿主交互调控的新维度。对于工业微生物生产和噬菌体治疗而言,ASO的非基因组编辑特性,避免了转基因限制,利于合规应用并提升安全性。噬菌体抗菌治疗日益受到关注,ASO工具的灵活性与高效性,赋予其在优化噬菌体组合、调节噬菌体适应性及在临床中针对特定耐药菌实施精准辅助治疗的广阔前景。技术使用中需注意ASO递送效率依赖于载体肽的选择和细菌细胞壁结构,不同菌株对CPP的敏感性不同,此外,ASO多以沉默而非完全失活靶基因为主,影响表型的显著性受靶标蛋白特性影响。未来,递送系统的优化如纳米颗粒以及其他穿透策略,结合计算预测模型的进步,将不断提高ASO技术的普适性和靶向精准性。结合CRISPR技术和传统遗传学,ASOs将成为噬菌体功能基因组学中不可或缺的工具。
总之,可编程反义寡核苷酸技术为噬菌体基因功能研究开辟了全新的路径,赋能对复杂病毒系统的深入理解和精准控制。其在基础研究、临床应用及工业生物技术领域展现的多样化潜力,预示着分子生物学探索和转化医学的新时代正在到来。随着相关技术持续发展,预计ASO将催生更多噬菌体相关的创新成果,推动疫病防控和微生物资源利用达到新的高度。 。