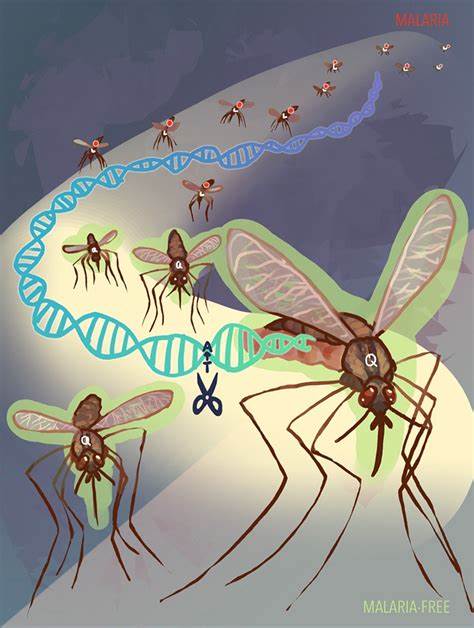
疟疾是一种由疟原虫引起的严重传染病,每年在全球范围内造成数百万人的感染和数十万人的死亡,尤其在儿童中死亡率极高。作为疟疾传播的主要载体,蚊子成为全球公共卫生领域的重点关注对象。然而,近年来由于蚊子对杀虫剂的抗药性增强以及疟原虫对治疗药物的抵抗力提高,传统的防治手段面临巨大挑战。加之新冠疫情的影响,疟疾防控工作遭遇严重阻碍,全球范围内疟疾控制形势日益严峻。就在这一背景下,一项由加州大学圣地亚哥分校与约翰霍普金斯大学等多方科研机构联合开展的研究,引入CRISPR基因编辑技术,成功开发出一种能够阻断蚊子传播疟疾的新型基因系统,为全球抗击疟疾提供了全新的解决方案。此次研究成果于2025年7月23日发表于国际顶尖学术期刊《自然》,受到了科学界的广泛关注。
传统防治疟疾的方法主要依赖杀虫剂和药物治疗,尽管取得了一定成效,但随着蚊虫和疟原虫适应性不断增强,防控效果逐渐减弱。研究团队创新性地利用CRISPR-Cas9基因编辑“剪刀”技术,针对蚊体内影响疟疾传播的关键分子——一种名为FREP1的蛋白,进行了基因精确改造。具体而言,科学家们将FREP1蛋白中的第224位氨基酸残基L224置换为Q224,一种天然变异体。这一看似微小的基因变化,显著阻断了疟原虫通过蚊子唾腺进入到人类体内的过程,从而有效切断了疟疾的传播链。令人振奋的是,虽然基因改造使蚊子无法传播疟疾,但它们仍然能够吸血和携带疟原虫,避免了生物生态系统的剧烈扰动,为后续的生态平衡维持提供了保障。位于约翰霍普金斯大学的研究团队在亚洲主要疟疾传播媒介东亚按蚊(Anopheles stephensi)身上开展了实验验证。
研究数据显示,改造后的蚊子能够有效阻止两种疟原虫的传播,证明了基因开关的广泛适用性和高效性。此次成功的基因置换技术被称为“等位基因驱动”(allelic-drive),其机制类似于传统基因驱动,能够确保携带Q224等位基因的蚊子后代在自然环境中快速扩散,从而实现整个蚊子种群的基因改造。这种传播方式对传统防控策略来说具有划时代的意义,因为它使得疟疾阻断特性能够自然遗传并持续存在,减少了频繁人工干预的必要。这项技术的另一个关键优势是,携带改良Q224等位基因的蚊子在生长发育和繁殖能力方面与未改造的蚊子无显著差异,避免了生物适应性缺陷导致基因型被自然淘汰的问题,从而保证了基因改良特性的稳定传承。研究负责人之一,来自加州大学圣地亚哥分校的Bier教授指出,替换这一单一氨基酸残基居然能对疟疾传播产生如此深远的影响,堪称生命科学领域的一大突破。该技术不仅阻断多种疟原虫种类,同时具备跨物种、跨地区适应性的潜力,为未来全球推广应用奠定了科学基础。
团队也在持续开展深入研究,探索Q224蛋白如何阻断疟疾病原体的具体分子机制,以期提升技术的针对性和安全性。此外,科研团队应用了一套可视化的荧光标记系统,通过红、绿、黄等色彩识别携带不同基因变异的蚊虫,有效跟踪基因驱动的扩散路径,进一步优化基因改造策略。作为一个创新生态方案,这套基因开关系统呈现出自我消灭的前景,即通过特定设计,使基因改造特性在任务完成后逐渐从蚊虫种群中消失,恢复生态自然状态,最大限度减少环境影响。加州大学圣地亚哥分校与约翰霍普金斯大学联合实验室表示,借助自然界存在的遗传变异作为基因改造基础,不仅降低了外来基因风险,同时彰显了“以自然之力对抗疾病”的理念,这种技术路径极大促进了基因编辑技术在公共卫生领域的合乎伦理和可持续发展。全球公共卫生专家普遍认为,这种基因改造蚊子技术一旦能在自然环境中安全推广,必将彻底改变疟疾的传播格局,帮助实现疟疾根除的长远目标。当然,推进基因驱动技术进入实际环境应用,还需要通过更为严密的安全性评价、生态影响预测和社会伦理讨论,确保其推广不产生潜在风险。
目前,该研究已获得比尔及梅琳达·盖茨基金会、美国国家卫生研究院及霍华德·休斯医学研究所等多方资金支持,为后续的研究与试验提供充足动力。随着全球抗击疟疾进入新的阶段,基因编辑技术的结合无疑为这场持久战注入了新的活力。从更广泛的意义上看,这一科研进展也开启了基因编辑在控制其他传染媒介疾病中的应用前景,诸如登革热、寨卡病毒等疾病的防控均有望受益。综合来看,基因开关阻断疟疾传播技术借助精准基因编辑,以解决蚊虫传播疾病的根本问题,为世界公共卫生带来希望和曙光。随着科技日益进步,跨学科合作不断深化,有望带来更多创新解决方案,推进人类健康事业取得更大成就。面对疟疾这一古老而顽固的传染病,以科学为武器,融合前沿基因技术,人类终将在这场与蚊虫的战争中赢得新的胜利。
。