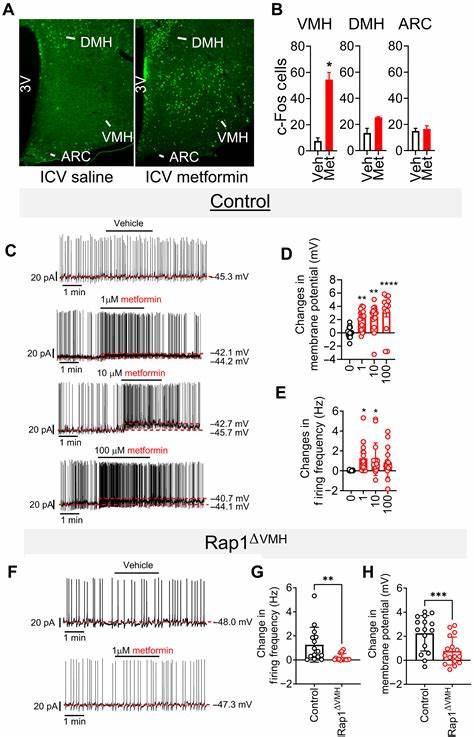
二甲双胍作为一种历史悠久且安全高效的口服降糖药,广泛应用于2型糖尿病的治疗中。尽管临床疗效显著,但其具体分子机制至今仍没有达成一致。传统观点侧重于二甲双胍在肝脏减少葡萄糖生成,或在肠道调节葡萄糖吸收与激素分泌,发挥降糖作用。然而,近期学者揭示了二甲双胍在脑内通过小GTP酶Rap1介导的神经机制,这一发现为二甲双胍的作用提供了全新的理解维度。研究表明,低剂量二甲双胍能够作用于脑中的Rap1蛋白,尤其是在大脑的腹内侧下丘脑区域,通过调节特定神经元活性,实现血糖水平的有效调控。相较于传统的肝脏和肠道机制,脑部路径展现出对低剂量二甲双胍更高的敏感性和特异性,且对于临床上常用剂量下的药效有重要影响。
实验使用特异性敲除小鼠模型,明确证明缺失脑部Rap1后,低剂量二甲双胍的降糖效果明显减弱,而对其他类型降糖药物依然敏感。这一发现恰恰突显Rap1是二甲双胍发挥疗效不可或缺的神经介质。同时,通过脑室内直接注射低剂量二甲双胍,也验证了其能够单独通过中枢神经系统调控血糖水平,且与食欲抑制无关,进一步支持了其神经内分泌调节的独立性。脑内Rap1的作用主要体现在腹内侧下丘脑中的甾体生成因子1(SF1)神经元上。该类神经元在调节整体葡萄糖代谢过程中扮演核心角色,二甲双胍通过作用于这些神经元,激活其电生理活动,促进内分泌调节,从而降低血糖。值得注意的是,Rap1的活性状态直接影响二甲双胍的药效。
表现为强制激活Rap1的转基因小鼠表现出血糖升高,且二甲双胍在这些模型中失去降糖显效,反映Rap1活性的敲低与抑制是二甲双胍作用的关键步骤。与此相对应,敲除Rap1尤其在SF1神经元中,则能以类似二甲双胍的效果降低血糖,说明遗传性降低Rap1功能具有潜在的治疗价值。以上实验均使用符合临床剂量范围内的低剂量二甲双胍,进一步说明脑Rap1介导的机制主要适用于临床常见的治疗剂量,超出这个范围的高剂量二甲双胍则主要通过外周组织其他机制发挥作用。研究还发现,脑内二甲双胍浓度仅为血清浓度的十分之一左右,但因Rap1依赖机制的高敏感性,足以实现显著降糖效果。这种中枢神经途径的发现极大地丰富了人们对二甲双胍药理的认识,也为未来药物设计提供了新的思路。低剂量二甲双胍的脑部作用提示,未来或可开发靶向脑部Rap1的小分子药物,从而实现更高效低剂量的糖代谢调节,降低用药副作用风险。
同时,研究中通过电生理学手段表明二甲双胍能够直接使SF1神经元的膜电位去极化,增强其发放频率,这种神经活动的改变可能成为调控全身糖代谢的关键神经环路基础。尽管目前研究证实了脑内Rap1作为二甲双胍作用的必要组成,但具体的下游神经环路及末端效应组织尚需进一步阐明。已知VMH SF1神经元能够通过迷走神经以及自主神经系统调控肝脏葡萄糖产生及周边肌肉的葡萄糖利用率。未来深入理解这些神经通路的机制,将有助于全面揭示二甲双胍的治疗网络。值得关注的是,研究还提示低剂量二甲双胍可能与脑内赖以定位的溶酶体AMPK信号复合物(PEN2-vATPase-AMPK)存在协调作用。新发现的脑溶酶体复杂体能响应低剂量的二甲双胍,通过调节Rap1信号,实现对神经元代谢的精细调控,也为二甲双胍中枢机制提供新的视角。
整体来看,低剂量二甲双胍通过脑中Rap1抑制,激活VMH SF1神经元,进而系统性调节血糖,成为二甲双胍作用机制中一个不可忽视的重要方面。该发现在临床和科研领域均意义深远。一方面强化了脑与代谢疾病的联系,南未来糖尿病治疗方案设计可纳入中枢神经调控。另一方面,也为理解其他糖尿病药物和神经信号转导之间的交互提供了参照。二甲双胍作为经典的“老药”,凭借全新的神经机制继续释放药效潜力,推动精准医疗向前迈进。患者和医务人员应关注二甲双胍剂量选择对药效和副作用的影响,低剂量服用时脑部Rap1的活性成为观察和干预的重要指标。
综上所述,脑内Rap1通路对于低剂量二甲双胍的降糖作用具有关键调节作用,是理解和优化二甲双胍临床应用的关键突破点。未来需要更多临床与基础实验的联合研究,深入探讨Rap1及其下游网络在不同糖尿病分型中的具体功能,促进个体化治疗策略的诞生。二甲双胍神经机制的发现,既是糖尿病基础研究的里程碑,也为临床提供新的治疗靶点,将有效推进全球糖尿病防控与管理水平。