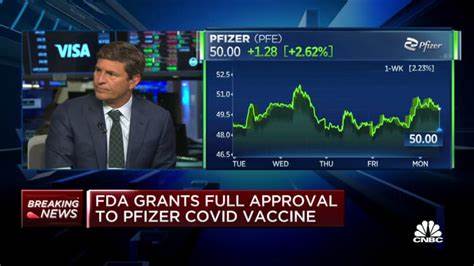
辉瑞制药公司(NYSE:PFE)近日宣布,美国食品药品监督管理局(FDA)正式批准了其针对新冠疫苗的补充生物制品许可申请(sBLA)。此项批准适用于由Pfizer-BioNTech联合研制的LP.8.1适应性单价新冠疫苗(COMIRNATY® LP.8.1; COVID-19 Vaccine, mRNA)。这款新疫苗的批准为老年人群和高风险群体提供了强化的免疫保护,为疫情防控注入了新的动力。 具体而言,批准范围涵盖65岁及以上的成年人,以及5至64岁之间存在至少一种潜在疾病、面临严重新冠结果高风险的个体。此前的多项研究和临床试验数据表明,这款疫苗在安全性和有效性方面表现出色,为广大高危人群的健康保障增加了砝码。 FDA批准此次sBLA的依据是丰富的临床和预临床数据,这不仅包括在儿童5至11岁人群中的安全及有效性试验结果,还特别指出了LP.8.1适应性单价疫苗相较于之前的JN.1和KP.2单价疫苗,能够更有效地激发针对多种流行的新冠病毒亚变异株(例如XFG、NB.1.8.1等)的免疫反应。
这表明新疫苗在面对不断变化的病毒谱系时具备更强的防护能力。 作为全球领先的生物制药企业,辉瑞始终致力于通过创新技术推动人类健康事业的发展。LP.8.1适应性单价新冠疫苗的研发与获批体现了辉瑞在mRNA疫苗技术上的先进实力,同时也反映了其应对公共卫生危机的敏捷反应。 COVID-19疫情暴发以来,疫苗的研发和推广成为全球关注的焦点。辉瑞-生物技术的合作生产了首批获得广泛认可的mRNA疫苗,为全球疫苗接种浪潮奠定了基础。然而,随着病毒不断变异,最初的疫苗配方面临着减弱的保护效果和防控挑战。
辉瑞针对这一问题迅速调整研发方向,推出了更具针对性的疫苗版本,力图覆盖最新的病毒变异株,提升整体的疫苗防护能力。 此次FDA的批准不仅意味着该疫苗获得了监管机构的认可,也为各国公共卫生部门制定并调整疫苗接种策略提供了科学依据。尤其是对于老年人和患有基础疾病的高风险群体而言,新疫苗的接种能够有效降低感染率和重症率,减少医疗系统负担。 未来,随着更多变异病毒的出现,对疫苗的适应性和更新将成为新常态。辉瑞公司表示,将继续进行相关临床试验和免疫效果评估,确保疫苗能够及时跟进最新的病毒株发展。此外,辉瑞还计划扩大疫苗的供应链和物流,保障在全球范围内能够快速分发并接种。
新冠疫苗的有效性直接关系到全球经济复苏和社会正常运转。目前,疫苗接种已成为遏制疫情蔓延、恢复国际旅行和经济活动的关键因素。辉瑞此次获批的疫苗版本,为实现群体免疫和降低病毒传播风险提供了有力支持。 然而,疫苗普及仍面临诸多挑战。包括疫苗犹豫、产能限制和地区分配不均等问题依然存在。辉瑞及其合作伙伴持续投入大量资源开展公共教育和提高疫苗获取的便利性,努力解决接种率滞后的瓶颈。
此外,全球卫生机构也在推动公平分配,确保中低收入国家同样能获得充足的疫苗供应。 与此同时,科学界对mRNA技术的关注持续升温。辉瑞的这款疫苗再次证明了mRNA平台的灵活性和优越性,为未来其他疾病的疫苗研发提供了技术模板。从癌症免疫治疗到罕见病治疗,mRNA技术的前景广阔,有望彻底改变传统生物医药领域。 投资市场方面,辉瑞作为一家具备强大研发能力和稳健财务表现的生物制药巨头,借此新疫苗的批准,有望进一步巩固其市场地位。分析师普遍认为,随着新疫苗陆续推出并进入商业推广阶段,辉瑞的营收和盈利能力将持续提升。
同时,疫苗产品线的丰富也增强了公司的抗风险能力和市场竞争力。 总结来看,辉瑞的这次sBLA批准不仅仅是一个简单的监管更新,更是全球抗击持续演变的新冠疫情的重要进展。通过科学不断创新和严格监管保障,疫苗接种的有效性和安全性得以提升。未来随着更多数据积累和新疫苗的持续推出,人类对新冠病毒的防控将更加从容和高效。 公众应继续关注卫生部门的疫苗接种建议,尤其是针对老年人和高危群体的加强针接种,以获得最佳防护效果。同时,只有全球范围内的疫苗公平分配和接种覆盖,才能最大程度遏制新冠病毒的传播,推动全世界回归正常生活轨道。
辉瑞公司凭借最新获批的LP.8.1新冠疫苗,再次彰显了其在公共卫生领域的领导地位和技术优势,为全球抗疫贡献了坚实力量。未来,期待借助创新科技实现更广泛的健康福祉,为人类战胜疫病创造更多可能。 。