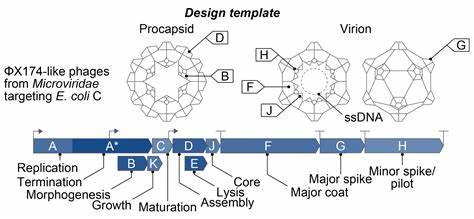
随着人工智能技术的迅猛发展,其在生命科学领域的应用不断扩展,尤其是在基因组学方面取得了突破性进展。近日,研究团队成功开发出首个由人工智能生成的完整基因组,标志着基因设计进入了一个崭新的时代。这项成就不仅是基因组学技术的飞跃,也为合成生物学、精准医疗以及抗生素替代疗法开辟了全新的可能性。 基因组设计的难度极高,其核心在于协调多个相互作用的基因和调控序列,使基因组能够实现复制、宿主特异性以及良好的进化适应性。传统的单一蛋白质设计已具挑战,而完整基因组设计则涉及更复杂的约束和潜在失败模式。这次团队选择了历史意义和实践价值兼备的ΦX174细菌噬菌体作为设计模板,它的基因组长度约5,386个核苷酸,包含11个基因,且具有重叠的基因结构,为人工智能模型生成基因组带来严苛考验。
为解决ΦX174基因组的重叠基因挑战,团队自主研发了一个基因注释流程,结合开放阅读框(ORF)搜索与同源性比对,实现对全部11个基因的精准识别。这一工具成为评估数千个AI生成序列不可或缺的环节,确保生成的基因组拥有必要的遗传元件保障噬菌体功能。 核心的技术突破在于对"Evo"系列基因组语言模型的定向微调。该模型原先训练于超过两百万个噬菌体基因组数据,具备一定的生成能力。但针对ΦX174特定的基因结构和序列特征,研究组通过监督微调方法,利用14,466个高相似度的Microviridae家族序列,优化模型以生成更加精确且多样的基因组序列。通过制定精细的输入提示和调整采样策略,模型能在保持亲缘关系接近的基础上,避免生成与野生型基因组过于相似的序列,增强了设计的新颖性。
为了衡量生成的基因组质量、宿主特异性及进化多样性,团队制定了针对序列完整性与功能保留的筛选标准,确保生成的噬菌体能特异感染实验用非致病大肠杆菌株(E. coli C),并保持其刺突蛋白的功能。实验结果显示,所有功能性AI设计噬菌体仅能感染E. coli C及其近缘菌株,未对其他菌株产生感染,证明了宿主范围的有效维持。 实验验证环节同样突破传统限制。通过Gibson组装技术合成噬菌体基因组后,转化入大肠杆菌C株,并在96孔板中监测其对细菌生长的抑制效果。该快速筛选方法在实验中检测了285个人工合成基因组,筛选出16个具备活性并经序列确认的功能噬菌体,进一步用于繁育和生物活性评价。 这些功能噬菌体相较于自然基因组含有数十至数百个全新突变,其中部分突变在自然界中未曾发现,体现出AI生成基因组超越了自然进化路径的能力。
最为引人注目的是一个名为Evo-Φ36的合成噬菌体,它成功整合了来自远缘亲戚G4噬菌体的DNA包装J蛋白,体现了AI对复杂蛋白质相互作用及补偿性突变的精准协调能力,验证了AI在整合多元遗传元件实现新功能上的潜力。 抗菌耐药是当今医学领域的重大挑战,传统抗生素面临效果不断减弱的困境。研究团队进一步测试了AI生成噬菌体在克服细菌抗性方面的能力。通过培育ΦX174抗药性菌株后,用多样化AI设计的噬菌体鸡尾酒成功克服了大肠杆菌的抗药性,在多个实验传代内显著阻断细菌生长,而传统单一噬菌体ΦX174则无效。 基因组重组是抗性克服的关键之一。成功噬菌体的基因组是多源AI序列通过重组产生的马赛克结构,表面暴露抑菌区域富含适应性突变,复杂多样的突变组合为细菌提供了难以全面抵抗的多条进化应对路径。
这一点突显了AI生成基因组在多样性创造上的独特价值,可有效提升噬菌体疗法对抗细菌抗药性的灵活性与持久力。 在确保生物安全及生物封闭方面,整个项目严格执行了超出常规的安全标准。实验仅使用非致病性的大肠杆菌菌株,所有操作均在专业的生物安全柜中完成,废弃物与设备严格管理,防止任何潜在的生物风险。此外,AI模型训练剔除了人类病毒序列,避免了生成潜在人类致病病毒基因组的可能性,工程流程中的模板设计亦确保了宿主特异性的严格保持,最大限度降低了滥用风险。 展望未来,AI基因组设计技术有望大幅推动噬菌体疗法的发展,尤其针对涉及植物病原菌及临床难治细菌,如绿脓杆菌和十字花叶菌等,提供精准、可调控的治疗方案。降低合成成本和提升AI模型能力将进一步扩大基因组设计的规模与复杂度,使基因组设计不再局限于既有自然序列,而能发掘自然进化未曾探索的新遗传组合。
这 次AI成功设计完整基因组,体现了基因组语言模型捕获与表达复杂进化约束的能力,也强化了计算方法与实验验证相结合的跨领域协作模式。基因设计有望成为生命科学新的核心能力,开启精准合成、功能重塑及疾病治疗的新篇章。未来,基于AI的基因组设计不仅将突破自然界生物多样性的限制,更将推动合成生物学进入从"读"和"写"基因到"设计"基因的新时代,助力人类更深刻理解和改造生命的根基。 。