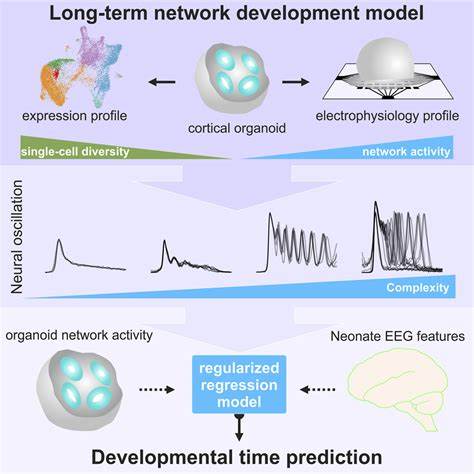
大脑皮层是人类复杂认知功能和行为的基础,其发育异常往往导致多种神经发育疾病和皮质障碍。近年来,随着干细胞技术和单细胞测序技术的发展,科学家们利用人类神经干细胞(hNSCs)体外模型,有效模拟了早期脑发育过程,揭示了众多皮质障碍的早期发病机制。这些研究不仅扩大了我们的认知视野,还推动了针对神经发育障碍精准治疗方法的开发。 皮质障碍是一类涉及大脑皮层结构和功能异常的疾病,涵盖微脑症、脑回缺如、结节症、多发性脑回畸形等多种临床表现。传统观点认为这些疾病主要源于晚期神经元分化和功能异常,但最新研究表明,许多皮质障碍的病因根源可能存在于神经干细胞阶段,即人类胚胎发育的早期阶段。神经干细胞作为神经系统初期的多能祖细胞,承担着细胞增殖、分化和组织构建的关键角色,其功能异常可能导致大脑皮层形成紊乱,进而诱发皮质结构和认知功能的多样性障碍。
通过对大量皮质相关疾病风险基因进行汇总,研究人员发现在人类胚胎第一孕期,即皮层神经发生早期阶段,许多疾病相关基因已在神经干细胞中表达。该发现颠覆了传统认为障碍发生在晚期神经元或胶质细胞阶段的认识,强调早期神经干细胞状态的脆弱性。研究利用GWCoGAPS非负矩阵分解算法分析了来源于体外培养的人类PSC(多能干细胞)衍生神经干细胞的转录组数据,描绘出不同疾病相关基因在NSC细胞周期进程和分化头阶段的表达峰值,明确区分了各类疾病在NSC发育时的关键「易感窗口」。 例如,微脑症相关基因如ASPM和CENPJ在神经干细胞的早期增殖状态(即传代2-3代)高表达,提示NSC前期细胞周期调控异常可能导致异常的脑容量与发育迟滞。相较而言,脑回缺如(LIS)相关基因表达峰值集中在中期神经胶质前体状态,反映出疾病发病机制与神经元生成和迁移紧密相关。此类时空分布的基因表达规律为疾病发生机制的时间定位和病理研究提供了重要参考,为未来干预治疗设计提出了潜在有效的关键发育期窗口。
除此之外,研究还揭示了不同疾病之间的基因调控网络存在较为复杂的相互联系和交叉,表明多个皮质疾病可能共享部分分子机制。核转录因子(TF)如FOXG1、DLX2、MEF2C和KLF4在调控神经干细胞命运决定中扮演枢纽角色,它们既是单一疾病的核心调控因子,也在不同疾病的信号通路中起着连接与桥梁作用。这种基因调控网络的交织有助于理解不同皮质疾病症状之间的相似性及其遗传学上的重叠,同时提示疾病表现的异质性可能源于基因网络中调控点的特异性受损。 对于这些调控网络的功能影响,研究者利用CellOracle多组学单细胞数据重建了分细胞类型的基因调控图谱,模拟转录因子功能缺失对细胞命运轨迹的影响。结果表明,不同转录因子的缺失在空间和时间上对神经干细胞及其后代细胞的分化方向产生差异性影响,既有促进神经元成熟转化的,也有延迟分化导致细胞命运偏离的复杂效应。这种精细的时空调控机制解析说明了为何相同基因变异可能引发不同的临床表型,强调了疾病个性化治疗的重要性。
特别值得关注的是,研究组对多位孤立性自闭症谱系障碍(ASD)患者来源的诱导多能干细胞进行了系统分析,发现这些患者神经干细胞存在显著的转录调控异常。包括FOXG1、MEIS2和POU3F2等关键脑区分区和命运决定转录因子在内的多个基因表达呈现显著变化,特别是在早期神经干细胞阶段,这些基因多调控脑的前后和背腹轴发育。此发现为理解ASD复杂的遗传和发育病理提供了明确生物学基础,支持早期脑区模式形成异常作为ASD发病机制之一的假说。 体外人类神经干细胞模型以及相关脑器官模型在高通量基因表达和调控图谱解析中的成功应用,极大推动了早期脑发育阶段神经疾病机理的研究。这不仅使科学家能够详细地观察细胞状态转变及其受损情况,也为药物靶点筛选、个体化网络药理设计和阶段性干预方案的开发提供了宝贵工具。结合跨物种转录组对比和多组学集成分析,这些研究正在逐步构筑起从基因突变到神经发育异常再到行为表型的系统理解。
然而,尽管技术进步使我们洞察了大量细胞机制和基因网络,但皮质障碍的病因依旧错综复杂。基因变异、多样的环境因素和表观遗传调控交互作用,共同决定了疾病的异质性和表型多样性。未来研究需要更大规模多样化患者样本的神经干细胞模型,结合遗传组学、表观遗传学与功能影像学数据,深度挖掘致病通路,解锁影响神经发育的多维度风险因素。 综合来看,利用人类神经干细胞体外模型探索皮质障碍的早期病理机制,是连接基础神经科学与临床神经遗传学的桥梁。精准定位风险基因表达时间窗口,揭示转录因子调控网络的动态变化,模拟基因功能缺失对神经细胞谱系选择的影响,为我们理解神经发育疾病的发生提供了全新视角。在这一基础上,未来基于神经干细胞的疾病模型将成为神经系统疾病早期诊断、生物标志物发现以及个性化治疗策略设计的重要平台,推动神经科学与再生医学迈向新的里程碑。
。