随着全球肥胖问题日益严峻,寻找有效的治疗策略刻不容缓。棕色脂肪组织(Brown Adipose Tissue,简称BAT)因其高效的能量消耗和产热功能,成为研究代谢调节和抗肥胖治疗的热点。近期研究发现,神经素1(Neuritin 1,Nrn1)作为一种局部代谢调节因子,在BAT的功能发挥中起着重要作用,成为调控能量平衡的新兴关键分子。 棕色脂肪组织以其独特的非颤抖性产热机制著称,能够通过线粒体内的脱偶联蛋白(UCP1)高效消耗脂肪和葡萄糖,释放热能,调节体温与能量代谢。BAT的活性与机体代谢健康紧密相关,其功能的激活被认为能有效抵抗肥胖与相关代谢疾病。传统上,BAT的活性调控主要依赖于交感神经释放的去甲肾上腺素,通过β3-肾上腺素受体介导的信号通路实现。
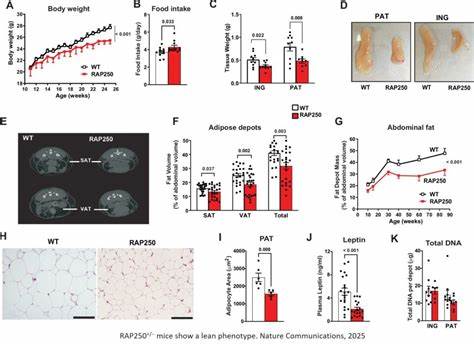
然而,越来越多的证据表明,BAT不仅仅是被动的效应器器官,还能分泌多种局部和全身调节因子(batokines),参与复杂的代谢网络调节。 神经素1原本作为神经系统中的一种促塑性神经肽被广泛研究,涉及神经元的生长、存活及突触可塑性。其在大脑中的表达与学习记忆、神经修复等功能密切相关。令人惊喜的是,最新研究发现,神经素1同样在棕色脂肪细胞中产生,并通过自分泌和旁分泌机制调控脂肪代谢与产热能力。 研究显示,RAP250(一种核受体共激活因子)在BAT中的表达与其代谢活性密切相关。RAP250缺失或表达降低会导致BAT中神经素1的大量上调,进而促进BAT的代谢活跃状态。
动物实验进一步验证了这一机制,局部基因沉默RAP250可显著提高BAT的葡萄糖氧化率、表达多种产热相关基因,如Ucp1、Ppargc1a和Dio2,促进线粒体功能与组织代谢。此外,腺相关病毒载体(AAV)介导的神经素1过表达实验表明,其能有效降低体脂和体重,显著提升能量消耗指标,强化体内代谢健康 状态。 神经素1在BAT中的功能体现出高度的局部调控特性。它的表达不仅在棕色脂肪细胞分化过程中不断增强,而且其蛋白质能够被细胞分泌,且分泌受β-肾上腺素受体激动剂刺激增强,说明神经素1作为一种新型的batokine,在调节BAT代谢活动方面发挥着关键的信号传导作用。值得注意的是,神经素1缺失的棕色脂肪细胞对β-肾上腺素受体激动剂的反应能力明显下降,表明其对于维持正常的交感神经信号响应能力至关重要。 在分子机制层面,神经素1的具体受体尚未明确,但已有研究提示其可能通过多种路径激活下游信号,包括蛋白激酶A(PKA)活性增强、线粒体呼吸链复合物蛋白的表达提升等,从而增强线粒体功能和产热能力。
研究用纯化的重组神经素1蛋白刺激棕色脂肪细胞,快速激活PKA底物的磷酸化,诱导产热基因表达,并显著刺激线粒体呼吸,进一步支持其在BAT中的自分泌/旁分泌作用定位。 神经素1不仅直接调节棕色脂肪细胞的新陈代谢,同时还可能影响BAT的神经元内环境。其过表达伴随着交感神经系统的重构,表现为酪氨酸羟化酶(TH)表达提升和非髓鞘施旺细胞数量增加,提示神经素1可能通过促进交感神经再生或神经网络重塑,间接支持BAT的功能增强。BAT中丰富的神经元连接是其应答体温调节和代谢需求的重要保障,这为理解神经素1在BAT中的多重作用提供了新视角。 在肥胖和代谢综合征的模型中,神经素1的调节作用尤为显著。RAP250缺失小鼠表现出更为瘦弱的体态和更强的胰岛素敏感性,这些效应部分归功于BAT功能的增强和神经素1的上调。
与此相对应的,神经素1的人工过表达同样带来体脂显著减少和能量代谢提升,而神经素1缺失则削弱BAT对β3-肾上腺素受体激动剂的生理反应,导致产热能力下降。 此外,人体基因关联研究亦揭示神经素1及RAP250基因与体重指数(BMI)间存在强相关性,支持其在人类代谢调控中的潜在重要性。鉴于神经素1独特的信号功能及其对能量代谢的深远影响,未来有望成为肥胖、2型糖尿病等代谢疾病的治疗新靶点。 展望未来,针对神经素1的调控机制的深入挖掘,将有助于开发创新的治疗策略。鉴于其局部作用的特性,调节神经素1表达或模拟其信号功能,可望实现精准激活BAT代谢,提升能量消耗,有效控制体重及代谢健康风险。同时,神经素1对交感神经系统的影响亦可能开辟神经代谢学新领域,丰富对BAT生理调控的认识。
总的来说,神经素1作为棕色脂肪组织的新型局部代谢调节因子,凭借其促进BAT产热能力、增强代谢活性及支持交感神经功能的综合优势,正成为代谢疾病研究的焦点。在全球肥胖和代谢综合征日益加剧的背景下,探明和利用神经素1调控BAT的潜力,或将为治疗相关疾病提供崭新且高效的方向。随着更多基础和临床研究的进行,人类或将通过调控这一分子实现对能量代谢的精细控制,迈向更健康的未来。 。