随着现代生活塑料制品的广泛应用,纳米塑料作为塑料降解的终极产物,日益成为环境中的重要污染因素。聚苯乙烯纳米塑料(Polystyrene nanoplastics, PS-NP)尤其引人关注,其微小颗粒易于穿透生物体的屏障,积累在肠道等关键部位,引发多重健康隐患。近期研究借助动物模型与细胞实验,深入揭示了PS-NP影响肠道微环境的多重机制,为我们理解纳米塑料对健康的潜在威胁提供了新的视角。 肠道作为人体最大的免疫和微生态系统,维系着宿主的营养吸收、免疫防御以及内外环境的平衡。PS-NP的摄入使其能够大量积聚于小肠、结肠及盲肠等肠道重要区域,甚至可通过组织间隙等途径渗透至肝脏等器官。实验显示,长期口服曝露PS-NP的小鼠其肠道黏膜屏障功能受到明显破坏,表现为紧密连接蛋白如ZO-1和闭合蛋白(Occludin)的表达显著下降,肠道通透性增加,诱发“肠漏”现象。
这种屏障损伤为肠道病原菌的入侵提供了可能,进一步引发炎症反应和免疫紊乱。 分子水平上,肠道细胞内多种微小RNA(miRNA)的表达谱受到显著改变。特别是miR-501-3p和miR-700-5p的水平上升与ZO-1基因表达的抑制呈高度相关,表明纳米塑料通过调控miRNA进而影响肠道上皮细胞的结构完整性。此外,肠道中黏蛋白MUC-13的表达同样受到抑制,黏液层的保护作用减弱,进一步加剧了肠道屏障的脆弱性。 纳米塑料不仅直接作用于肠道细胞,还通过影响肠道微生物群落,实现与宿主的复杂互动。PS-NP的存在导致肠道菌群组成发生微妙变化。
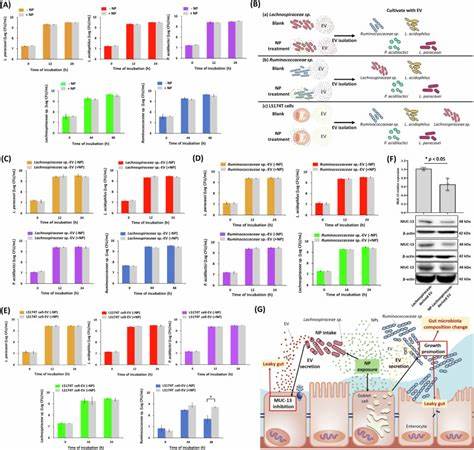
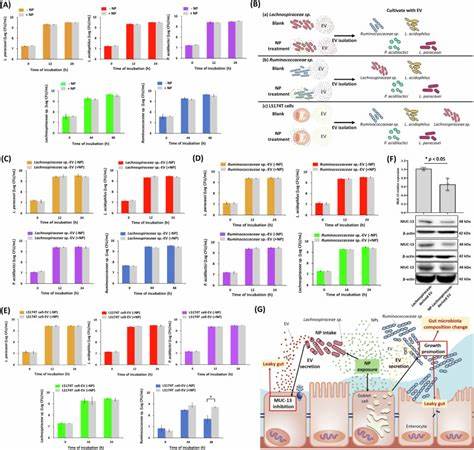
尽管整体多样性未发生剧烈变动,但Ruminococcaceae和Lachnospiraceae这两个关键菌群的丰度上升,而有益的乳酸菌则减少。通过流式细胞分选技术证实,纳米塑料能够被Lachnospiraceae摄入,这一过程改变了菌群释放的胞外囊泡(Extracellular Vesicles, EVs)的性质。受到纳米塑料影响的Lachnospiraceae-derived EVs可抑制肠道细胞的MUC-13表达,破坏黏液屏障。同时,肠上皮细胞尤其是杯状细胞(Goblet cells)分泌的EVs携带了多种miRNA,这些miRNA同样受到纳米塑料调控,促使Ruminococcaceae的增殖,进一步推动肠道微生态失衡。 尸体组织与体外细胞模型均显示,纳米塑料促使肠道杯状细胞分泌EV的数量显著增加,而且其miRNA载体组成被重塑。这些EVs通过微量调控肠道紧密连接蛋白和黏蛋白的表达,参与肠道屏障的动态调节。
值得注意的是,PS-NP影响的这些miRNAs不仅作用于肠上皮细胞,还可能穿透菌群细胞,参与不同物种间的信号传递,体现出纳米塑料在肠道生态系统复杂网络中的调控功能。 目前,纳米塑料对肠道环境的干扰被认为是多因素作用下的综合结果。首先,纳米塑料的颗粒自身进入肠道细胞及关键菌群,直接引起细胞功能障碍和微生物活性改变。其次,纳米塑料介导的miRNA表达及EV分泌调节,形成了宿主-菌群间复杂的信号反馈回路,进一步加重肠道屏障和菌群平衡的紊乱。此外,纳米塑料对免疫细胞的影响也不容忽视,免疫应答的激活或抑制都可能参与病理过程中的不同阶段。 鉴于上述影响,纳米塑料的环境暴露危害日益突出。
现代人通过食物链摄入纳米塑料,体内积累引发的肠道疾病风险不容小觑。临床上,肠道屏障受损和微生态失衡与多种消化道疾病如炎症性肠病、肠易激综合征乃至结直肠癌密切相关。因此,探索纳米塑料对肠道健康的长远影响具有重要的公共卫生意义。 为深入了解纳米塑料的毒理效应,未来研究需要关注几个关键方面。首先,应扩大动物模型研究,评估不同剂量和暴露时间对肠道及全身健康的影响。其次,解析纳米塑料在肠道微环境中与不同菌群的相互作用及其介导的信号通路,将有助于开发针对性调控策略。
第三,进一步探索杯状细胞释放EV中miRNA的功能及其与菌群的跨物种通信机制,为肠道疾病的预防和治疗创新提供理论基础。 此外,提高公众对纳米塑料污染的认识,加强环境治理和塑料制品管理,是减少纳米塑料暴露的有效途径。政策制定者和相关企业应加快推出替代材料,推动绿色生产与循环经济发展,降低塑料废弃物对生态和人类健康的双重威胁。 综合来看,聚苯乙烯纳米塑料不仅通过物理方式损伤肠道屏障,而且通过复杂的分子信号和微生态调控,深刻影响肠道微环境的稳定。其对肠上皮细胞功能和菌群结构的双重冲击,为理解环境纳米塑料污染带来的健康挑战提供了科学依据。面对日益严重的纳米塑料危机,跨学科整合研究与环境政策的协同推进显得尤为紧迫,为保障人类的肠道健康和整体福祉构筑坚实的防线。
。