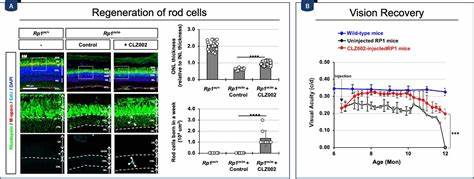
视网膜作为人类视觉系统的关键组成部分,其细胞的损伤和退行性变化直接导致视力丧失,严重影响患者生活质量。像视网膜色素变性、青光眼等视网膜退行性疾病,因视网膜感光细胞和神经细胞无法自我修复,导致视力不可逆下降。虽然部分冷血动物如斑马鱼拥有较强的视网膜再生能力,但哺乳动物却普遍缺少有效的视网膜细胞再生机制。这一现象长期以来困扰眼科及神经科学研究领域。穆勒细胞(Müller glia,MG),作为视网膜中唯一的主要胶质细胞,不仅维持视网膜结构和功能稳定,也在冷血的脊椎动物中充当再生干细胞的角色,能够在损伤后重编程为视网膜前体细胞以替代受损神经元。然而,哺乳动物的穆勒细胞却缺乏这一再生能力,阻碍了基于自身细胞再生修复的治疗途径的发展。
最新发表在《自然通讯》的开创性研究揭示了Prox1蛋白在限制哺乳动物穆勒细胞再生潜能中的关键抑制作用,为重启哺乳动物视网膜再生能力指明了方向。 Prox1(Prospero-related homeobox 1)是一种高度保守的同源盒转录因子,既参与神经系统发育中的神经前体细胞分化,也调控细胞周期,促进细胞退出增殖周期进入分化状态。研究发现,在哺乳动物受损视网膜中,Prox1蛋白显著积累于穆勒细胞中,但该蛋白并非源自穆勒细胞自身基因表达,而是通过邻近神经元向穆勒细胞转移的方式获得。这种细胞间蛋白转移为穆勒细胞对损伤的反应带来新的调控层面。通过详尽的实验,研究团队确认了这种Prox1的细胞间转移限制了穆勒细胞向视网膜前体细胞的重编程与增殖能力。推动这一发现的关键实验包括利用基因剔除技术特异性地敲除视网膜内先进先出转录因子Prox1,结果显著恢复了穆勒细胞的增殖及其向视网膜前体细胞的转化。
此外,研究人员开发出一种针对Prox1的抗体片段,该抗体通过腺相关病毒(AAV)载体递送至眼内,成功中和和阻断游离于细胞间的Prox1,从而减弱其向穆勒细胞的转移。此方法激活了穆勒细胞的增殖,促进视网膜神经元的再生,延缓了小鼠视网膜色素变性模型的视力丧失。该策略比传统细胞外生长因子或转录因子过表达更具针对性和潜在安全性,并且可望为临床治疗提供新思路。斑马鱼等再生强的冷血动物视网膜中并未观察到受损后Prox1水平提升,也无相应细胞间转移,暗示Prox1的积累是哺乳动物穆勒细胞再生受限的一个关键障碍。这种进化差异揭示转录因子细胞间转移在哺乳动物视网膜再生限制中的独特作用,提示未来调整这一机制有望恢复哺乳动物的视网膜再生潜力。该研究还揭示了Prox1影响穆勒细胞再生的相关信号通路变化,例如相关Notch信号通路及细胞周期关键基因的调控,进一步完善了对穆勒细胞重编程过程的分子理解。
通过单细胞RNA测序和细胞谱系追踪,研究团队成功描绘了Prox1剔除后,穆勒细胞分化为视网膜前体细胞的细胞状态转变轨迹。同时,眼内注射重组Prox1蛋白或维持其转移能够抑制猴鱼或小鼠中穆勒细胞的增殖和再生,证实了Prox1作为抑制因子的功能。尽管近年来针对穆勒细胞激活的多种转录因子和外部信号通路(如Ascl1,Notch和Wnt信号)已被报道,其单独的激活往往不足以实现有效再生。Prox1的发现为补充哺乳动物视网膜再生缺失的抑制机制提供了新的视角,并建议未来的治疗策略需同时考虑抑制Prox1转移和激活促进再生的信号,从而实现更彻底的功能恢复。治疗角度看,针对人类晚期视网膜色素变性患者肌勒细胞中Prox1的异常积累,阻断其转移释放了抑制,促进视网膜神经细胞再生的研究前景令人期待。研究团队已在早期和晚期多种视网膜退行性小鼠模型中探明抗Prox1抗体表达可有效减缓视力丧失进程并促进新神经元形成,尽管效果尚未能完全恢复视力,但为分子治疗的临床应用打下坚实基础。
未来需解决抗体或AAV载体的长期表达稳定性、免疫反应以及协同调控其他促进重编程因子的问题,在临床前研究中完善策略。此外,鉴于Prox1作为家族同源蛋白,在其他神经系统区或组织中的潜在表达和功能,需确保治疗的局部性和特异性以避免副作用。学术界对Prox1的细胞间转移机制及如何实现特异性阻断也展开了积极探索,部分涉及特定糖胺聚糖作为摄取介质,这为精准药物设计提供了方向。总结来看,破坏Prox1蛋白的跨细胞转移成功激活了哺乳动物视网膜内穆勒细胞的再生潜能,克服了长期让视网膜退行性疾病患者失望的再生极限。结合基因疗法及蛋白转移抑制策略,有望催生新一代针对视网膜再生的临床疗法,有效缓解视力衰退甚至逆转视网膜损伤。伴随未来对其安全性和效果的不断验证,该方向无疑将为众多视网膜疾病患者带来福音,为以自身细胞再生实现视力修复打开新篇章。
。