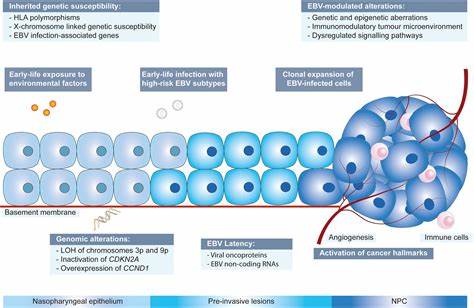
Epstein-Barr病毒(Epstein-Barr virus,简称EBV)与鼻咽癌之间的关联已被临床和流行病学研究反复证明。近年分子生物学和基因组学研究进一步揭示,EBV不仅仅作为致癌因素存在,更通过复杂的方式参与宿主细胞基因表达调控和三维基因组结构的重塑,从而在肿瘤发生、进展和转移过程中扮演关键角色。理解这些机制对早期筛查、靶向治疗和免疫治疗策略的开发具有重要意义。本文将围绕EBV如何重塑基因组结构、驱动鼻咽癌转移的分子机制、临床意义以及未来研究方向进行深入解读和展望。 EBV与鼻咽癌的关系和感染谱系 EBV是一种普遍存在的人类疱疹病毒,终身潜伏于B细胞和部分上皮细胞中。多数人在童年或青少年期感染EBV,绝大部分个体无明显临床表现或仅出现短暂的自限性感染。
然而在特定人群和遗传背景下,尤其是东南亚和南中国沿海地区,EBV感染与鼻咽癌的发生具有强烈关联。鼻咽癌肿瘤组织中常可检测到EBV基因组和病毒潜伏期基因的表达,这些病毒产物参与肿瘤细胞的生物学行为改变。 EBV如何影响宿主基因表达:从表观遗传到三维基因组 EBV通过多条途径改变宿主基因表达。其编码的潜伏蛋白(如EBNA1、LMP1、LMP2A等)和病毒微小RNA能够直接或间接地调节宿主的转录因子网络、信号通路及表观遗传状态。表观遗传层面上,EBV影响DNA甲基化、组蛋白修饰和染色质可及性,导致某些肿瘤抑制基因被沉默或致癌基因被激活。更为复杂的是,EBV能诱导宿主细胞三维基因组(3D genome)的重构,这意味着染色体在核内空间的折叠方式、增强子与启动子的相互接触模式发生改变,从而长期改变基因表达程序。
染色质重塑与增强子劫持:激活侵袭与转移相关基因 三维基因组的组织对于基因的准确调控至关重要。研究表明,肿瘤中异常的染色质环路和拓扑关联域(TAD)边界变化可使增强子接触到非目标基因,形成所谓的"增强子劫持"现象。EBV通过其产物或通过改变宿主染色质结合蛋白的分布,能够破坏正常的TAD边界,促成致癌基因与强增强子间的新型互作。这类相互作用可以上调与细胞迁移、上皮间质转化(EMT)、基质降解和血管生成相关的基因,使肿瘤细胞具备更强的侵袭与转移能力。 病毒蛋白与宿主结构蛋白的相互作用 EBV潜伏期蛋白与宿主细胞核内的结构与调控因子发生相互作用,影响基因组的物理组织。例如,EBNA1不仅维持病毒环状基因组在宿主细胞中的复制与分配,还能与宿主染色质发生结合,影响局部的染色状态。
LMP1被视为EBV的主要致癌因子之一,能够激活NF-κB、MAPK等信号通路,诱导促侵袭基因表达并改变细胞外基质相互作用。病毒微RNA可以靶向多种抑癌基因和免疫调节分子,间接促进染色质和转录调控网络的全局改变。 免疫逃逸、炎症微环境与肿瘤转移的协同作用 肿瘤的转移并非单一基因或单一路径的结果,而是肿瘤细胞与其微环境相互作用的产物。EBV感染改变的基因表达谱会影响肿瘤免疫微环境,包括下调主要组织相容性复合体(MHC)分子的表达、分泌免疫抑制性因子、招募免疫抑制性细胞类型等,使肿瘤细胞更易逃避免疫监视。持续的低度慢性炎症在促进基质重建、诱导血管新生以及为肿瘤细胞提供迁移通道方面也起到重要作用。EBV通过诱导特定趋化因子和基质金属蛋白酶的表达,加速肿瘤细胞穿越基底膜并侵入循环系统。
外泌体与远程通讯:病毒载体在转移中的潜在角色 越来越多证据显示,肿瘤细胞分泌的外泌体携带蛋白、核酸及病毒产物,参与构建前转移微环境(pre-metastatic niche)。EBV感染的细胞生成的外泌体可能含有病毒微RNA和促侵袭因子,这些小颗粒能够远距离调节受体组织的细胞,促使其变得更易于肿瘤细胞着床和生长。通过这种方式,EBV不仅在原发灶内影响基因组结构和基因表达,还可能通过分泌介质影响远处器官的微环境,从而促进转移形成。 临床意义:早期筛查与分子标志物的价值 了解EBV如何重塑基因组并驱动转移,能为临床提供多层面的启示。首先,血浆或唾液中EBV DNA水平长期被用作鼻咽癌的筛查和复发监测指标。对基因组重塑特征相关的基因或非编码RNA进行检测,或许可提高早期发现和风险分层的精确度。
其次,肿瘤组织中发生的特定染色质重构与异常增强子活动留下的基因表达指纹,可以作为预后标志物,帮助判断患者发生远处转移的风险。精确的分子分型有望指导个体化治疗方案的选择。 治疗新方向:从抗病毒到表观遗传与免疫联合策略 针对EBV相关鼻咽癌的治疗策略正在多线并进。传统治疗以放疗和化学放疗为主,但对部分晚期或复发转移病例疗效有限。理解病毒介导的基因组重塑提示了新的干预点。抗病毒策略在理论上能够减少病毒活性与潜伏蛋白表达,但在临床上直接抗病毒药物对潜伏期EBV效果有限。
表观遗传药物,如DNA甲基转移酶抑制剂和组蛋白去乙酰化酶抑制剂,可能逆转EBV诱导的某些沉默表型,恢复肿瘤抑制基因表达并增强免疫原性。靶向增强子-基因互作或阻断关键转录共激活因子亦是潜在方向。免疫治疗方面,PD-1/PD-L1抑制剂已在部分鼻咽癌患者中显示出疗效,联合肿瘤疫苗、T细胞疗法或以EBV为靶的策略有望提高响应率。将表观遗传治疗与免疫治疗联合以提升肿瘤抗原呈递和免疫识别,可能是未来的重要趋势。 研究挑战与未来方向 尽管对EBV与鼻咽癌关系的理解已有长足进步,但仍存在诸多挑战。首先,如何精确描绘病毒如何在不同细胞类型中重塑三维基因组,哪些重构事件是驱动性的、哪些是过程性或被动性的,有待更大规模和更高分辨率的基因组学研究来区分。
其次,如何在临床样本中可靠检测染色质重塑相关的生物标志物并将其转化为可操作的诊断或治疗决策工具,需要跨学科合作与标准化方法。再次,动物模型和细胞模型如何更真实再现人体EBV潜伏与肿瘤微环境的复杂相互作用,是评估新药和组合疗法效力的关键。最后,基于患者遗传背景与环境因素(如饮食、吸烟、烟草使用等)的差异,研究应更多关注人群异质性与精确医学的实现。 公众健康与预防策略 在高发地区,公众教育与早期筛查对降低鼻咽癌死亡率有现实意义。加强对EBV传播途径的宣传、鼓励高危人群定期接受血浆EBV DNA筛查、提升基层医疗机构对鼻咽癌早期症状的识别能力,将有助于早期发现并改善预后。未来若疫苗研发成功,预防性疫苗有望从根本上降低与EBV相关的多种恶性肿瘤发病率。
结语 Epstein-Barr病毒通过多层次、多机制影响宿主基因组,从表观遗传修饰到三维基因组重塑,再到免疫微环境调节,构成了促使鼻咽癌发生、进展与转移的复杂网路。将这些基础科学发现转化为临床可用的早筛工具和精准治疗手段,是未来研究的核心任务。跨学科合作整合基因组学、表观基因组学、免疫学与临床医学,将推动新的诊疗策略问世,为EBV相关鼻咽癌患者带来更精确、更个体化的治疗希望。若需了解与个人相关的筛查或治疗建议,请咨询专业医疗机构获得个性化指导。 。