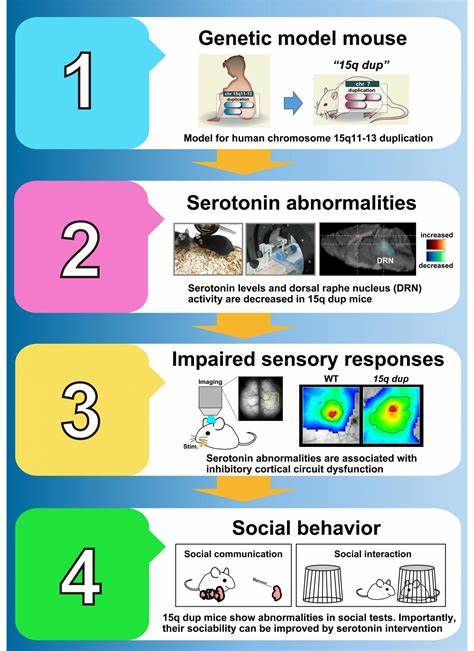
近日,来自斯坦福医学院的研究团队发布了一项引人注目的科学成果,成功逆转了自闭症小鼠模型的相关症状,为揭示自闭症谱系障碍(ASD)的神经学机制和探索创新疗法提供了宝贵线索。自闭症作为一种复杂的神经发育障碍,至今尚无根治方法,其病理机制亦未完全阐明。本次研究聚焦于大脑中名为"网状丘脑核"(reticular thalamic nucleus, RTN)的关键区域,通过科学调控其神经活动,发现该区域的过度活跃是驱动自闭症核心症状的重要因素。斯坦福研究人员利用基因改造的小鼠模型,模拟人类自闭症的表现,详细观察这些小鼠在光线刺激、气流碰触甚至社交互动时大脑的神经反应。数据显示,与正常小鼠相比,这些自闭症小鼠的网状丘脑核区域显著过度活跃,且伴随突发性神经放电,引发类似癫痫的发作。该发现首次揭示了网状丘脑核在自闭症和癫痫两种疾病中的关键作用,也解释了为何这两种疾病往往共存的现象。
针对这一机制,团队施用了实验性药物Z944,这种药物具备抑制神经过度兴奋的效果。服用该药物后,自闭症小鼠表现出令人振奋的改善,癫痫发作频率下降,过度运动、重复行为和社交障碍等核心症状明显减轻。此外,研究还运用了基于DREADD技术的神经调控手段,科学地设计基因以使神经元对特定药物产生反应,进一步精准抑制网状丘脑核的异常活性。通过此方法,不仅成功逆转了自闭症小鼠的行为异常,甚至在正常小鼠中通过人为激活该区域,诱发了类似自闭症的行为障碍,充分证明了该脑区在发病机制中的核心地位。自闭症与癫痫的高度重叠在临床上长期困扰着医生和患者,斯坦福团队的发现为两者的共通病理机制提供了坚实的科学依据。癫痫在自闭症患者中的发病率远高于普通人群,约占30%,而普通群体中仅为1%。
揭示网状丘脑核过度活动可能同时引发癫痫和自闭症相关行为,有望催生同时治疗两种疾病的新型疗法。此次研究成果已于2025年8月20日发表于《科学进展》(Science Advances)期刊,由约翰·胡格纳德教授和博士后学者张成洙领衔完成。这项跨学科合作不仅整合了神经科学、遗传学与药理学技术,也体现了神经调控技术在精准医学中的巨大潜力。此次实验药物Z944正在进行多项临床前研究,未来有望在人类自闭症和癫痫治疗中发挥积极作用。网络丘脑核作为感官信息在丘脑与大脑皮层之间传递的"过滤器",其正常功能对于认知、感知及行为调节至关重要。过度的兴奋性活动打破了大脑信息处理的平衡,从而诱发感官敏感、社交回避、运动异常等自闭症症状。
对该区域的干预展现出纠正这一异常的可能性,也为深入理解自闭症大脑内部的神经环路异常提供了新的视角。与此同时,该研究引发了关于睡眠和自闭症关系的进一步思考。部分与会学者建议,未来应关注自闭症儿童的睡眠质量问题,因其可能影响感知和认知机制,甚至反馈调节脑部异常兴奋。据相关评论提出,夜间使用睡眠辅助药物可能提高自闭症儿童的生活质量,减少行为异常。从广义角度看,斯坦福团队的突破不仅加深了我们对自闭症神经基础的认知,还推动了基于脑区域功能调节的治疗策略发展。未来研究有望在优化药物设计、提升神经调控技术应用范围、探索早期诊断标志物等方面取得新进展,进一步为自闭症及相关神经疾病患者带来福音。
总之,这项由斯坦福医学院领导的研究,成功确定了网状丘脑核过度活跃作为驱动自闭症行为的关键因素,并通过药物和神经调控技术实现了小鼠自闭症症状的逆转,为自闭症的治疗开辟了前所未有的新路径。作为自闭症及神经科学领域的重要里程碑,相关研究成果不仅丰富了基础科学知识,也推动了临床转化医学的进程,彰显了科学探索改变生命的巨大力量。期待未来更多国内外科研机构携手,以此为契机,共同攻克自闭症以及脑神经疾病的挑战,造福广大家庭和社会。 。