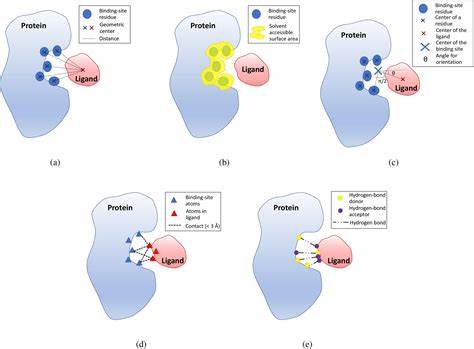
蛋白质与小分子配体的结合亲和力,是评估药物分子活性和功能的核心参数。准确预测这种结合强度,不仅能加速药物研发流程,还能大幅度降低实验成本和时间投入。传统的实验方法虽然直观可靠,但面临耗时耗力和资金高昂的挑战。数值模拟技术如自由能微扰(FEP)虽然精确,但其计算量大、多维度的物理过程让大规模筛选变得不切实际。面对这些瓶颈,麻省理工学院与Recursion合作推出的Boltz-2模型引起了业界和学术界的巨大关注。作为开源的基础模型,Boltz-2不仅改变了药物分子与蛋白质结合亲和力预测的格局,更展现出加速药物设计进程的无限潜能。
Boltz-2被定位为一款生物分子基础模型,能够同时预测蛋白质-配体复合物的三维结构和结合亲和力。其区别于以往模型的最大亮点是速度和准确性的巨大提升,达到了比现有自由能微扰方法快上1000倍的计算效率,同时保持高精度。这种突破来自于对训练数据的丰富提升,包括采用分子动力学轨迹数据及Boltz-1模型自我蒸馏预测结果。通过引入大量动态结构信息,Boltz-2有效扩展了模型的理解深度和泛化能力,于无须额外微调的情况下,便能显著提升对未知蛋白质靶点的预测效果。Boltz-2还引入了多项用户友好和控制性极强的设计。方法条件化让用户能够基于特定实验模态进行模型调用,保证模型输出符合实验环境。
模板引导功能允许输入参考结构,嵌入先验知识引导预测,增强了预测的定制性和可解释性。结合口袋接触约束,Boltz-2确保预测结果满足给定结构条件,为药物设计师提供更精准的结构信息作为决策依据。这些特性使得Boltz-2不仅是理论上的计算工具,更成为连接实验数据与药物研发需求的强大桥梁。Boltz-2 Affinity作为模型的一部分,更是通过数百万来自文献的校正批量测定值进行训练,在准确度上首次接近了物理基的FEP方法,为早期虚拟筛选带来了革命性的效率提升。相比以往深度学习模型,它标志着计算化学领域的重大进展,让高精度的小分子设计变得触手可及。该模型的开源性质极大地推动了学术交流和产业应用的融合,MIT和Recursion联合发布的代码、模型权重和训练管道对学界和企业均开放,这为未来创新药物研发提供了宝贵资源。
Boltz-2在药物研发流程中的应用前景十分广阔。从高通量虚拟筛选,到先导化合物优化,再到后期结构指导设计,Boltz-2可谓贯穿多个关键环节。借助其快速预测能力,研发人员能在极短时间内筛选出高亲和力候选分子,显著提升筛选命中率和效率,降低因无效候选带来的资源浪费。此外,模型的可控性和可解释性也加速了药物设计的迭代流程,使得实验设计更加精准有据,同时降低因模型黑箱效应带来的不确定性。在生物医药行业愈发重视AI辅助药物研发的当下,Boltz-2无疑具备引领下一代计算药物设计的潜力。它不仅优化了计算速度与精度的平衡,更融合了物理模拟和深度学习两大方法优势,成为结构生物学和药物化学交叉领域的代表性里程碑。
随着模型不断迭代,涵盖更为丰富的蛋白质类型和配体范畴,结合实验数据的持续更新,Boltz-2将在未来助力新药发现步入全新时代。综上,Boltz-2凭借其卓越的技术创新和开源共享精神,加速并优化了小分子与蛋白质结合亲和力的预测,突破了传统物理模拟的性能瓶颈。它为早期药物筛选提供了高效、精准的计算手段,推动了虚拟筛选的规模化应用,进而引领药物发现领域步入智能化、数字化新时代。对于科研人员与制药企业而言,充分利用Boltz-2无疑将成为提升研发竞争力、缩短药物上市周期和降低研发成本的重要助力。未来随着技术不断完善,与其他AI技术和高性能计算资源结合,Boltz-2将在个性化医疗、抗体设计及复杂疾病靶点挖掘等更广领域发挥巨大作用,开拓更为广阔的应用前景。