导语 人类与动物的摄食行为并非仅由味觉决定,同一种甜味在饥饿与饱腹状态下会引发截然不同的反应。最新神经科学研究揭示了一个关键的脑区 - - 床核(BNST,bed nucleus of the stria terminalis),它如同一个"消费开关",将来自味觉系统的信号与身体内部状态结合并转化为实际的摄食或饮水行为。了解这个枢纽的工作方式,有助于我们更清晰地把握食欲调控的神经机制,并为治疗体重异常、食欲减退以及药物作用机制提供新的视角。 背景与研究切入点 味觉信号从舌头的味觉感受器出发,经过一系列神经环路传递到大脑皮层与边缘系统,而味觉的"身份"(甜、咸、苦等)与"价性"(有吸引力或令人厌恶)往往由不同区域编码。中央杏仁核(CEA)长期被认为在赋予味觉情感价值方面起重要作用;例如,甜味通常被赋予积极的价性,而苦味则被赋予负面价性。问题在于,如何将"我觉得它好吃"转化为"我要吃下去"?也就是说,如何将感知与实际的摄食行为耦合?最新研究把目光聚焦到了BNST,提出它作为一个将感觉与内部需求整合并控制具体消费行为的关键节点。
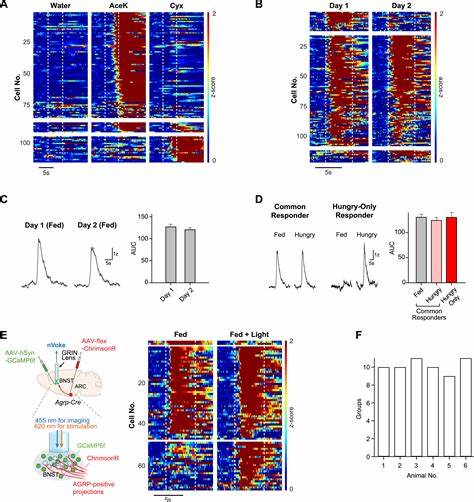
主要发现与证据链 通过单细胞转录组学、原位活动标记、光纤光度学、微型内镜钙成像、单向病毒追踪与光遗传学等多模态方法,研究者们描绘出一条从中央杏仁核到BNST,再到行为输出的明确回路。 在中央杏仁核中,有一类表达前毒啡肽基因(Pdyn)的神经元对甜味具有高度选择性。单细胞测序结合即时早期基因(Fos)标记显示,接触甜味后被激活的杏仁核细胞几乎都表达Pdyn。利用光遗传学激活这类Pdyn神经元,动物会对原本平淡无奇的水显示出强烈的追逐与自我刺激行为;相反,抑制这些细胞会特异性削弱对甜味的偏好但不影响对脂肪等其他 appetitive 刺激的吸引。这些证据把Pdyn阳性的中央杏仁核神经元确立为赋予甜味积极价性的关键群体。 投射追踪显示,Pdyn阳性杏仁核神经元向BNST投送密集投射。
BNST中以GABA能(VGAT表达)神经元为主,对于甜味刺激呈现强烈响应。更进一步,选择性刺激杏仁核Pdyn向BNST的轴突末梢能够把水"转化"为可被摄入的目标:在光刺激条件下,动物会因为感觉到"甜"而大量舔水;但当相同投射被激活却没有水可供摄入时,动物并不会增加对"干舔"的尝试,这表明这一路径促进的是实际的消费行为而非简单的奖赏寻求。 BNST作为内外信息整合的枢纽 对BNST的功能更深入的探索表明,它不仅仅响应甜味或杏仁核的输入,而是同时接受多路来自体内能量与电解质需求的调制。例如源自下丘脑弓状核(ARC)的AGRP神经元 - - 已知作为饥饿信号的强效发动机 - - 能直接投射到BNST。光遗传性刺激AGRP末梢或通过饥饿状态诱导激活,都会显著增强BNST对甜味的反应,并且在单细胞层面上招募先前未响应甜味的神经元参与编码。 微型内镜下的单细胞钙成像显示,BNST神经元群体对味觉刺激与内在状态的联合编码具有高度维度性。
相同的甜味在饱腹、饥饿或钠缺乏等不同状态下,会引起不同规模与不同组合的神经元活动参与。训练解码模型可以在刺激后很短的时间内准确预测出动物所处的内部状态与所呈现的味觉刺激类型,说明BNST群体活动既包含味觉身份信息也包含生理需求信息。 功能操控与行为后果 光遗传学和化学遗传学的双向操纵进一步验证了BNST在消费行为中的核心作用。广泛激活BNST中的GABA能神经元会引发非选择性的消费冲动。动物在BNST被激活时不仅摄入固体食物、甜溶液与高浓度盐溶液,还会尝试摄食通常令人厌恶的苦味物质,甚至对并不存在的"假食物"表现出强烈摄取行为;这说明BNST的高水平活动会把多种外界刺激强行转化为消费动机。相反,抑制BNST会明显抑制对各种食物和液体的摄取,无论动物是否处于饥饿状态。
BNST与临床相关性:从减重药物到恶病质 BNST不仅是基本研究的发现点,也与临床药物的作用有直接关联。临床上用于减重与胰岛素调节的GLP-1受体激动剂(如semaglutide/司美格鲁肽)在分子水平与神经回路上影响食欲与恶心等行为。研究发现semaglutide可以在BNST中特异性诱导Fos表达,且该激活主要落在表达PKCδ的BNST神经元亚群。过去有研究显示激活PKCδ阳性BNST神经元会抑制进食,这提示GLP-1类药物在发挥体重下降作用时,BNST可能是其重要但此前被低估的靶点之一。 反向思路同样具有临床意义。许多疾病状态(如化疗相关的恶病质)会导致严重的食欲丧失与体重下降。
通过化学遗传学刺激BNST中的GABA能神经元,研究者在动物模型中成功缓解了由顺铂(cisplatin)引起的体重下降,提示在某些需要逆转食欲丧失的病理情况下,BNST调控或可作为潜在干预点。 机制性的思考与开放问题 BNST为何能把感觉与需求结合得如此高效?研究者提出BNST如同一个"消费拨轮":其基础活动水平决定了消费行为的整体倾向,而具体的选择性由输入端决定。来自杏仁核的"味觉价值"通路决定了外界刺激的情感属性,而来自下丘脑及其他内稳态回路的输入(例如AGRP代表的饥饿信息或来自钠需求系统的信号)则调整BNST的响应门限与参与神经元的集合,最终在该区域形成综合输出,去激活下游的执行路线,从而促成吞咽、咀嚼、寻找食物等完整的消费行为链。 然而也有若干未解之谜。BNST本身是一个异质性极强的结构,包含多种细胞类型与互相平衡的亚电路。光遗传学在群体水平的操纵虽然能展示功能因果,但也不够精细以解答哪些子回路具体负责"选择性消费"与哪些负责"非选择性冲动"。
BNST的输出目标尚需更系统的解析,以确认从BNST到运动与分泌系统的具体路径。此外,人类大脑的BNST与动物模型之间存在解剖与功能上的差异,如何将这些发现有效转译到临床仍需谨慎评估。 潜在应用与未来方向 对BNST功能的深入了解为多种临床挑战提供了新思路。对于肥胖与过度进食,选择性激活抑制性的BNST亚群或许可以与现有的GLP-1类药物协同,增强食欲抑制效果同时减少恶心等副作用。对于恶病质与进食障碍,目标化提升BNST的消费输出可能帮助恢复患者食欲、延缓体重丧失与改善生活质量。重要的是必须开发比光遗传学或病毒载体更安全、可控的临床干预手段,比如小分子药物、基因调控工具或靶向神经调控技术。
后续研究应聚焦于BNST的细胞图谱与投射特异性,结合单细胞分辨率的功能成像、诱发性记忆追踪与行为学分析,绘制BNST完整的输入 - 处理 - 输出地图。同时,需要在更高等级的动物模型乃至人类中评估BNST相关回路的保守性与可操作性,以确定是否可在临床中安全有效地调节这一"消费拨轮"。 结语 BNST在将味觉信息与内部生理状态整合并转化为消费行为方面扮演了中心角色。通过连接赋予味觉价性的杏仁核与传递饥饿信号的下丘脑,BNST让动物能够根据需求灵活调整摄入量与偏好。对BNST的理解不仅深化了我们对食欲与摄食行为神经机制的认知,也打开了对体重调控、食欲丧失与药物作用机制开展新型干预的可能性。在未来,精准解析BNST的回路与细胞类型,将有望推动更安全有效的治疗策略,造福受食欲失衡影响的患者群体。
。