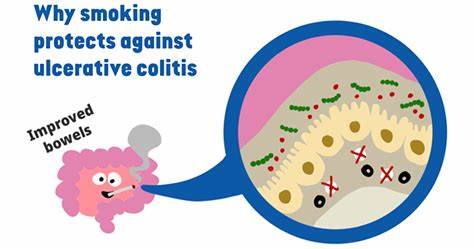
近年来,科学家们对肠道健康的研究日益深入,尤其是炎症性肠病(IBD)领域的突破性发现备受瞩目。炎症性肠病主要包括克罗恩病和溃疡性结肠炎,这两种慢性疾病都以肠道炎症为特征,严重影响患者的生活质量。然而,一个几十年来困扰医学界的谜团是:为什么吸烟会增加克罗恩病的风险,却反而对溃疡性结肠炎有保护作用?这一矛盾的现象近日被日本RIKEN综合医学科学中心的研究团队成功破解,为人们理解吸烟与肠道免疫之间的复杂关系提供了新的视角。消息一经发布,便引发了学术界和医学界的广泛关注。 该研究由著名免疫学家大野宏志领衔,他们通过结合人类临床数据与小鼠模型实验,发现吸烟过程中产生的某些代谢产物促进了口腔细菌,特别是链球菌属,在大肠黏膜层繁殖。这种细菌迁移现象在吸烟的溃疡性结肠炎患者中尤为明显,而不抽烟或戒烟者则未见此表现。
通常,当我们吞咽唾液时,口腔细菌会顺着消化道被排出体外,但吸烟改变了肠道环境,使这些细菌能够在肠道黏膜上定殖。 深入分析代谢产物后,研究人员发现了多种在吸烟者肠道中含量较高的小分子物质,其中最具代表性的是羟基苯醌(hydroquinone)。这一物质促进了链球菌在肠黏膜的生长和稳定存在。令人惊讶的是,这些口腔细菌并非简单入侵者,而是通过激活特定的免疫细胞 - - 辅助性T细胞1型(Th1细胞)发挥作用。 Th1细胞在肠道免疫反应中起调节作用,它们通过抑制Th2型免疫反应减少肠道炎症,这是溃疡性结肠炎的重要致病机制之一。 为了更加明确细菌及免疫细胞之间的关系,研究团队从吸烟者口腔分离出了10株不同的链球菌菌株,随后在体内实验中给予患有克罗恩病和溃疡性结肠炎的鼠模型。
结果显示,给予链球菌中的Streptococcus mitis菌株后,小鼠的溃疡性结肠炎症状显著缓解,而克罗恩病模型则症状加重,这与临床中吸烟对两种疾病截然不同的影响相吻合。 全面的免疫机制分析表明,在溃疡性结肠炎中,口腔链球菌通过诱发Th1细胞的活跃,成功抑制了过度的Th2型免疫反应,从而减轻了炎症反应。但在克罗恩病中,Th1细胞本身是病理性炎症的推动者,因此链球菌的作用反而加重了病情。这种免疫调节的双重性深刻揭示了不同炎症性肠病的免疫机制差异。 尽管吸烟似乎对溃疡性结肠炎患者带来了暂时的症状缓解,但吸烟本身伴随着心血管疾病、癌症及多种慢性疾病的巨大健康风险,因此绝非理想的治疗方式。基于此次发现,研究人员提出了一种更为安全、长远的治疗前景:通过使用含有链球菌的益生菌疗法或补充类似羟基苯醌这类促进有益菌群生长的益生元,模仿吸烟带来的肠道益处,避免吸烟带来的负面影响。
这一突破不仅为溃疡性结肠炎的治疗提供了新的思路,也揭示了口腔菌群与肠道健康之间的密切联系,强调了"口-肠轴"在身体免疫调节中的重要性。未来,口腔微生物组的系统研究有望进一步揭开炎症性肠病的发病机制,同时促使针对个体化菌群调整的精准医疗成为可能。 此外,这项研究也为肠道菌群移植和新型微生态疗法奠定了理论基础。现今,益生菌产品繁多,但对其科学依据的认识仍在不断深化。借助像Streptococcus mitis这样的特定菌株,配合代谢产物的调节,定制化菌群干预或将成为未来IBD管理的新趋势。 总的来说,日本RIKEN团队的发现解开了吸烟保护溃疡性结肠炎这一医学困惑的谜底。
它强调了吸烟产生的特定代谢产物对口腔菌群迁移至肠道并激活特定免疫反应的重要作用。该机制使肠道内环境得以调整,减少了炎症并缓解症状。虽然吸烟本身并不可取,但通过科学手段模拟其有益机制,有望带来安全有效的治疗新方案。 这项研究在国际权威期刊《Gut》发表,无疑是肠道免疫学和炎症性肠病治疗领域的一大进展。未来的工作将集中于如何将这些基础发现转化为具体的临床干预手段,推广至患者群体,改善他们的生活质量。随着微生物组科学的日益成熟,肠道健康的个性化管理将迎来崭新时代,口腔与肠道菌群的相互作用将成为重要的探索方向。
无论是溃疡性结肠炎患者,还是关注肠道健康的普通大众,理解肠道菌群与免疫系统间复杂关系的重要性都不容忽视。通过合理膳食、科学生活方式调整及未来潜在的益生菌和益生元产品干预,保持肠道菌群平衡或将成为预防和缓解炎症性肠病的关键。日本RIKEN的这一创新研究点燃了我们对肠道菌群调控新方向的希望,也展示了从基础科学到临床应用的广阔前景。 。