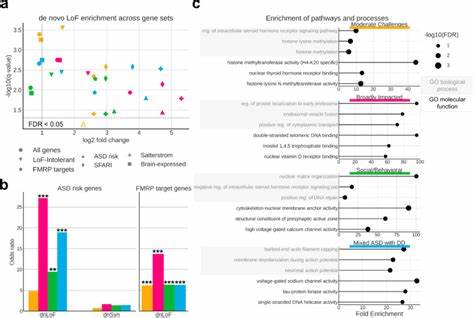
自闭症谱系障碍(ASD)是一种复杂神经发育疾病,其核心特征包括社会交往障碍和限制性重复行为模式。然而,随诊断标准的拓宽,自闭症的表现形式愈加多样,临床异质性极其显著。学界长期面对的一大难题是如何在纷繁复杂的表型差异中厘清潜在的生物学机制和遗传基础。最近一项基于大规模人群的研究,通过创新的混合生成模型方法,成功分解了自闭症的表型异质性,揭示出不为人所熟知的遗传程序,为自闭症的精准医学发展开辟了新路径。 这项研究以超过五千名自闭症儿童及其非自闭症兄弟姐妹为样本,整合社会交往、重复行为、认知功能、行为共病等多维度的临床表型数据,以及他们的全外显子组测序数据,采用基于概率的生成混合模型(Generative Finite Mixture Model, GFMM)对数据进行深入解析。不同于以往只聚焦单一症状或遗传变异的方法,GFMM能够全面捕捉个体多种共存症状的复杂关联,从而将自闭症群体划分为具有临床及遗传学显著差异的四个潜在类别。
这种“以人为中心”的分析方法更贴合现实的个体差异,避免了将个体碎片化为单一特质的局限性。 研究中识别的四种自闭症潜在类别分别是“社交行为型(Social/behavioral)”、“发育迟缓混合型(Mixed ASD with DD)”、“适中挑战型(Moderate challenges)”与“广泛受累型(Broadly affected)”。“社交行为型”群体核心特点为社交交往和重复行为的困难明显,同时伴有注意力缺陷、多动症和焦虑抑郁等精神共病,但发育迟缓相对不突出。“发育迟缓混合型”则融合了语言及运动发育迟缓,认知障碍,以及部分核心自闭症表现的多样化。他们的相关遗传背景显示既有罕见的继承变异,也伴有新生突变,且这些变异主要影响胎儿期大脑发育基因的表达。 相比之下,“适中挑战型”病患的症状较为轻微,遗传变异多聚焦于进化约束较低的基因,提示这些基因的功能影响有限和多样化。
而“广泛受累型”则表现出多系统多领域的严重受累,携带更多高冲击力的新生突变,尤其是在高度保守的基因和易损的脆性X精神发育迟缓蛋白(FMRP)靶基因中负担最重,反映出这类患者在认知和行为方面的复杂挑战。 深入的遗传分析表明,这些不同类别的表型差异反映了遗传变异在不同发育阶段及不同脑细胞类型的异质性效应。例如,发育迟缓混合型患者的突变多参与胎儿及新生期的神经元发育过程,而社交行为型患者则更多涉及出生后基因的调控变异,特别是在内源性抑制性神经元中。这种时间和空间上的表达模式差异与临床表现的发育里程碑密切相关,为理解自闭症的病程差异提供了强有力的生物学证据。 此外,研究还揭示了自闭症相关的关键分子通路。社交行为型富集于染色质重塑、DNA修复调控及微管相关活动,提示基因表达调控和细胞骨架动力学在该类中的核心作用。
发育迟缓混合型则表现出神经元动作电位和钠通道活性的异常,反映神经信号传导的根本障碍。适中挑战型专注于组蛋白修饰与染色质组织,暗示表观遗传机制参与轻度表现型的形成。这些功能通路的分化强化了按表型分类对遗传机制开展精准研究的重要性。 这一综合研究的另一亮点是其对多维度临床表型数据的系统整合,包括家长报告的早期发育里程碑、行为问卷量表和临床诊断记录,结合外显子组序列及多层遗传变异评估,给予我们更具信度和广度的解读视角。通过在独立的西蒙斯单核苷酸谱系(SSC)数据集中的复现,验证了这一四分类模型的稳健性和广泛适用性,增强了其临床转化前景。 这项研究为解密自闭症的遗传异质性提供了系统且可操作的框架,揭示了不同表型背后独特的基因作用程序,并指明了遗传变异对大脑发育不同阶段及细胞类型的差异性影响。
未来基于此框架,临床诊断有望更加精细和个性化,治疗干预也可针对不同类别的病因和机制进行差异化设计,促使精准医学在自闭症领域的落地。 总结来看,自闭症谱系障碍并非单一疾病,而是不同遗传和发育轨迹所形成的多样综合体。通过先进的统计模型解析多维表型异质性并结合遗传学数据,科学家们正逐步揭开自闭症的神秘面纱,深入发现其内在生物学规律和复杂遗传网络。未来结合更多类型的组学数据、更丰富的临床表型及纵向追踪,将进一步丰富我们对自闭症异质性的理解和干预策略,为广大自闭症患者提供更为精准有效的支持和帮助。自闭症研究的这一新篇章,标志着向着生物学基础与临床实践深度融合迈进的重要进展,为社会和医学领域带来巨大希望。