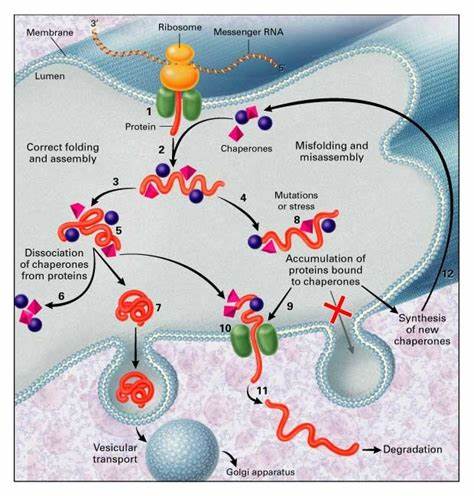
蛋白质的正确折叠对维持细胞功能和生命活动至关重要。作为细胞内重要的蛋白质合成和加工场所,内质网承担着三分之一真核蛋白的折叠与成熟工作。内质网内的分子伴侣蛋白网络通过识别新合成的客户蛋白,协助其正确折叠,防止异常聚集和错误加工。长期以来,科学界关注的焦点是这些伴侣蛋白如何通过分子层面的相互作用实现功能配合,而最近一项研究揭示了内质网中伴侣蛋白通过形成多伴侣蛋白凝聚体实现了空间和时间上的高度组织,这在蛋白质折叠的效率和精确性提升中起到核心作用。该凝聚体以PDI家族成员PDIA6为支架,依赖于钙离子浓度调控,集聚了包括Hsp70族BiP、J域蛋白ERdj3、另一种二硫键异构酶PDIA1以及Hsp90家族成员Grp94等关键伴侣。蛋白质生物化学活性检测和细胞内观察均表明,这些凝聚体不仅促进了客户蛋白如前胰岛素的折叠,更有效防止了蛋白质的错误折叠和聚集。
伴侣蛋白凝聚体的发现为解密内质网蛋白折叠网络提供了崭新的视角,且其动态受钙离子浓度调控,是细胞应对内质网压力的重要机理之一。研究团队通过高分辨率结构生物学手段,详细解析了PDIA6的结构特征和凝聚体形成机制。PDIA6包含两个具有催化活性的硫氧还蛋白样结构域a0和a,以及一个非催化的b结构域。PDIA6通过其a0域尾端的延伸螺旋形成纳摩尔亲和力的二聚体,这是构建凝聚体多价作用基础的重要步骤。其连接a0和a域的带正电荷的柔性连接肽段则作为分子开关,通过电荷相互作用与b域表面受钙离子调节形成动态、瞬态结合,促使多个二聚体间连接,启动凝聚体的相分离过程。钙离子浓度在数百微摩尔的变化,即生理状态与应激状态间的转换阈值,正好对应其凝聚体组装与解散的开关,体现了内质网钙信号对蛋白加工功能的调控能力。
细胞活体实验中,PDIA6以凝聚体的形式分布在内质网,并且表现出典型的液-液相分离所具有的流动性和动态交换,这些凝聚体在面对内质网应激时,如出现未折叠蛋白负荷增加或钙离子耗竭时,快速解散以响应细胞当前需求,展现出高度的适应性。进一步的免疫共定位分析确定了凝聚体不仅涵盖PDIA6本身,同样富集了其他关键伴侣如BiP、ERdj3、PDIA1及Grp94,构成早期客户蛋白处理的折叠工厂。对比未进入凝聚体的内质网伴侣蛋白,如糖结合伴侣Calreticulin和Calnexin,强调这一复合体在蛋白质早期折叠阶段的专业分工。以胰岛素前体蛋白为模型客户,经PDIA6凝聚体辅助折叠的细胞表现出显著提高的胰岛素分泌能力,而破坏凝聚体形成的PDIA6变异体则引发胰岛素分泌减少和未折叠前体积累,印证了多伴侣凝聚体在促进客户蛋白精准有效折叠中的功能必要性。普遍意义上,消失的凝聚体导致内质网应激信号增强,错误折叠蛋白聚集增加,内质网膜流动性降低,细胞存活率下降,表明伴侣蛋白凝聚体的稳定性直接关联内质网功能优化与细胞健康维持。该发现不仅深化了对内质网蛋白质量控制复杂性的理解,也启示生物医学领域探索通过调控伴侣蛋白凝聚体功能以缓解蛋白质折叠疾病的新策略,如糖尿病、神经变性疾病及癌症等。
当前,生物学领域越来越认识到细胞内多蛋白相互关联形成的液态凝聚体是调控细胞生命活动的重要方式,这些膜无关的结构通过快速可逆组装和解散对细胞环境变化作出高效响应。多伴侣蛋白凝聚体典范性地体现了这一机制在内质网蛋白折叠中的应用,为未来细胞蛋白质组稳态的调控机制研究打开新方向。随着多学科技术的结合使用,包括NMR光谱分析、X射线晶体学、高分辨光学成像和蛋白质组学,研究人员正逐步揭示伴侣蛋白凝聚体的调控网络、组分及其动态行为。此外,伴侣蛋白凝聚体的钙依赖性相分离机制还提示细胞利用钙信号精准调控蛋白质折叠机理,有助于快速协调蛋白质合成与质控需求,优化细胞对内质网压力的响应速度。未来,了解和操控这些凝聚体或将为蛋白质折叠疾病开发新型治疗方法提供可能。总结来看,多伴侣蛋白凝聚体作为内质网蛋白折叠的高级功能单位,通过PDIA6为核心支架,组建起富集多种关键伴侣的动态结构,有效保障了蛋白质折叠的空间聚焦与时间调控,增强了蛋白折叠的精确性和效率。
这体现了自然界在细胞内分子网络系统的设计智慧,也是细胞适应环境压力、保障功能稳态的关键生物学现象。未来对多伴侣蛋白凝聚体的研究将持续推动我们对内质网蛋白质代谢的认知,并对相关疾病的诊断和治疗产生重要影响。 。