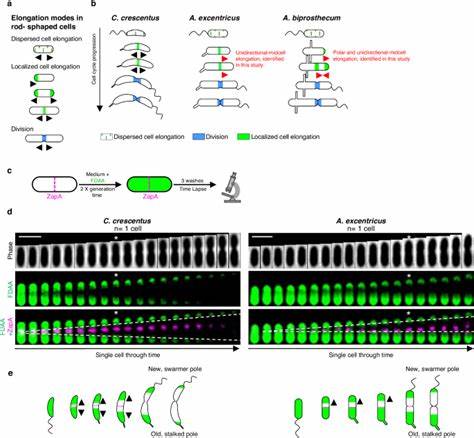
细菌的生长和分裂是微生物生命活动的重要组成部分,其中细胞伸长过程扮演着核心角色。作为维持细菌形态和实现细胞分裂的基础机制,细胞壁中肽聚糖的合成和重塑决定了细菌的形状与大小。近年来,借助荧光D-氨基酸(FDAA)技术对肽聚糖合成过程的动态追踪揭示了细胞伸长方式的多样性,尤其是在近缘细菌种之间展现出高度的表型可塑性,这挑战了过往认为近缘种细菌采用统一伸长机制的认知。细菌通过环状肽聚糖层赋予自身结构的坚韧,这种细胞壁主要由肽聚糖合成酶如青霉素结合蛋白(PBP)及SEDS蛋白介导。在细菌伸长过程中,细胞壁的生物合成和重塑受到称为延长体(elongasome)和分裂体(divisome)的多蛋白复合体严格调控,这些复合体在不同物种间既保守又具有变异性。近年来,针对Caulobacteraceae科中若干近缘物种的研究为我们呈现了异常丰富的细胞伸长模式差异,使我们得以窥见细菌细胞生长策略背后的进化动态。
以模式菌Caulobacter crescentus为例,它以中部双向伸长模式著称,细胞壁在分裂平面附近合成并向两极扩展。然而,其近缘种Asticcacaulis excentricus却表现出单向中部伸长,肽聚糖合成主要向新极推进,而另一种亲缘细菌Asticcacaulis biprosthecum则结合了顶极和单向中部的伸长机制。通过对PBP2的细胞定位追踪发现,PBP2在C. crescentus中分布较为分散,而在A. excentricus中则显著聚集于中部且偏向新极,驱动单向肽聚糖合成。该蛋白的定位和活性直接关系到细胞壁合成的空间方向性,抑制PBP2活性可导致肽聚糖合成失调并形成细胞膜膨胀。此外,类似的单向中部伸长模式还在较远亲缘的Rhodobacter capsulatus中得到验证,说明这种伸长策略并非偶然,而可能在较广泛的菌群中具有一定适应优势。此类细胞伸长的调控多样化体现了细菌面对不同生态环境和进化压力时,如何通过重塑保守的细胞壁合成机械实现形态与生长机制的适应性演化。
该研究还揭示了延长体组分的功能组装及其定位调控具有高度的可塑性,即使在亲缘关系紧密的物种中,肽聚糖合成的空间动态也可显著不同。除PBP2外,许多蛋白如细胞分裂蛋白FtsZ与极性蛋白DivIVA也在调控细胞壁合成的空间定位中发挥多样作用,从而实现细胞形态的多样性和应答环境的灵活性。不同伸长模式不仅影响细胞的形状,还可能与细菌特有结构如茎极的定位相关联,暗示细胞形态与其伸长策略存在密切的互作与共进化关系。进化树分析显示,伸长机制在Alpha蛋白菌门内部存在多次独立的演化转换事件,进一步支持细胞伸长表型具有显著的演化可塑性。细菌可通过调节伸长机制以适应环境变化、资源竞争和形态功能的多样需求,如饥饿条件下的伸长策略切换或特殊形态的形成等。从应用角度看,深入理解细胞壁合成酶在细胞伸长模式中的作用对抗生素的开发具有重要意义,尤其是针对PBP2等关键酶的特异性抑制,有望实现对细菌生长机制的精准干预。
此外,荧光D-氨基酸工具的持续创新与应用为细胞壁动态研究提供了强有力的视觉证据,启发了对细胞生理学及微生物生态学的更深入理解。综上,细菌细胞伸长展示出的表型可塑性不仅挑战了传统生物学观点,也开拓了对微生物形态演化和生长调控的新认识。未来,结合结构生物学、基因组学和高级显微成像技术的多维度研究,必将进一步揭示细菌生长形态背后的分子机制及其生态功能,同时帮助我们对抗细菌感染和发展新型抗菌策略提供坚实理论支撑。