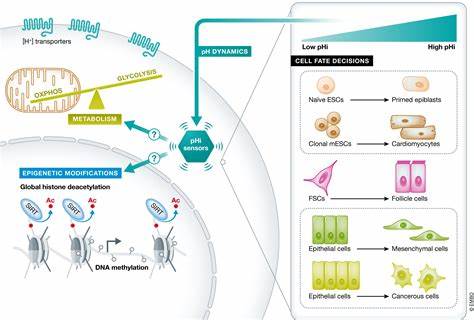
组织再生是生物体在受损后恢复结构和功能的核心过程。细胞命运决定在这一过程中扮演着关键角色,传统观念多聚焦于转录因子的调控网络,而近年来研究却表明,代谢活动尤其是能量代谢的变化,也在细胞分化和命运选择中发挥着重要作用。三羧酸循环(TCA)作为细胞能量代谢的中心环节,不仅为细胞提供ATP,还生成多种代谢物,这些代谢物能够参与调节表观遗传修饰,直接影响基因表达和细胞状态的转变。α-酮戊二酸(αKG)是TCA循环的重要中间产物,作为氧依赖性双加氧酶的必需辅酶,参与DNA和组蛋白的去甲基化,是连接代谢状态与基因表达调控的桥梁。最新研究发现,在肠道这一多谱系组织中,TCA循环酶的表达呈现明显的谱系特异性差异,这种代谢异质性直接影响了细胞的分化轨迹和功能状态。肠道上皮由肠道干细胞(ISC)不断更新,干细胞自我更新并向吸收细胞和分泌细胞两大主要谱系分化。
吸收细胞负责营养物质的吸收,新陈代谢活跃,ATP需求高;而分泌细胞群体虽较少,但包括潘氏细胞、杯状细胞、肠嗜铬细胞等,主要执行免疫防御和屏障维护功能。肠道干细胞及其后代经过多步分化,代谢活动发生显著变化。ISC偏重于糖酵解获得能量,而分化为吸收细胞则依赖于增强的线粒体氧化磷酸化(OXPHOS),以满足快速增殖和高能耗需求。相反,分泌谱系表现出较低的线粒体活性和TCA循环酶表达水平,主要依赖代谢物供给其合成功能。通过对小鼠肠道细胞和类器官模型的单细胞RNA测序及qPCR分析,研究揭示αKG脱氢酶复合体(尤其是其关键亚基OGDH)在吸收细胞谱系中表达上调,而在分泌细胞谱系中明显下调。OGDH的表达受转录因子HNF4的调控,HNF4是肠道吸收细胞的谱系决定因子。
HNF4直接结合OGDH启动子促进其转录,使得吸收细胞能够维持高效的TCA循环,满足能量和生物合成需求。OGDH下调则导致αKG水平升高,这不仅影响TCA循环的碳流,还改变了细胞内αKG/琥珀酰辅酶A比值,从而激活αKG依赖的去甲基化酶作用,促进分泌谱系相关基因的表达和分化。实验中,通过基因敲降OGDH或补充细胞可渗透型αKG,可观察到肠道干细胞更倾向于向分泌谱系分化,同时吸收谱系细胞在OGDH缺失下出现能量代谢障碍和细胞死亡。此现象揭示OGDH在不同谱系中的功能二元性。分泌细胞依赖较低的OXPHOS活性及较高的αKG水平,支持其合成分泌产品的特殊代谢需求,而吸收细胞则需要充分的TCA循环活力和能量供应。进一步的代谢流追踪实验显示,分泌谱系细胞更依赖谷氨酰胺代谢生成αKG,而吸收谱系细胞能够利用多种碳源维持TCA循环活性。
αKG作为去甲基化酶的辅因子,促进DNA羟甲基化5hmC的形成,解除了关键基因如Spdef的甲基化抑制,加速分泌细胞分化。研究通过体内模型验证,肠道受损后,OGDH表达升高,αKG水平下降,伴随分泌细胞数量减少和组织修复能力减弱,这是炎症性肠病如克罗恩病和溃疡性结肠炎等疾病的典型特征。相应地,抑制OGDH或补充αKG能够恢复分泌细胞分化,增加细胞内5hmC水平,促进组织再生和炎症缓解。动物模型中,诱导性Ogdh敲降导致吸收细胞功能障碍及肠道结构破坏,但相较之下,补充αKG则主要促进分泌谱系扩增,提升肠组织修复速度。多重免疫荧光和单细胞转录组分析显示,αKG干预增强了secretory谱系内细胞的分子多样性和重塑潜能,促进了组织再生过程中的细胞可塑性。肠道干细胞分化受到代谢程序的动态调控,代谢状态既是细胞命运选择的结果,也是驱动力。
HNF4作为吸收谱系的转录调控开关,调节OGDH的表达,实现基因调控和代谢重编程的耦合,有效支持吸收细胞的生理功能。相反,OGDH下调及αKG积累通过表观遗传机制促进分泌谱系分化,展现了代谢节点评估与调控细胞命运的复杂机制。以上发现不仅丰富了我们对组织再生中代谢与细胞命运关联的理解,也为代谢干预治疗肠病提供了理论基础。针对OGDH或αKG的调节能特异性诱导分泌细胞分化,改善组织屏障功能及炎症环境,为溃疡性结肠炎、克罗恩病等慢性肠道炎症疾病的治疗提供了新型策略。此外,这一代谢调控模式可能适用于其他多细胞组织的再生修复,促进细胞工程和再生医学领域的发展。未来研究需进一步阐明αKG依赖双加氧酶家族中具体成员的机制差异及其与转录网络的互作,揭示代谢重塑如何在空间和时间尺度上精准指导细胞谱系选择。
结合代谢组学、表观基因组学与单细胞测序技术,深化对代谢信号在组织稳态与修复中的作用理解,将推动代谢靶向疗法走向临床转化。总之,代谢适应不仅满足细胞的能量和生物合成需求,更通过调控关键代谢物如α-酮戊二酸及其相关酶的表达,深刻影响细胞分化和组织再生。肠道作为研究多谱系细胞命运决策的重要模型,充分展示了代谢与转录调控的紧密结合。通过基于代谢的精准干预,有望实现细胞谱系选择的精细调控,提升组织再生和功能恢复的效率,为复杂疾病提供创新疗法。