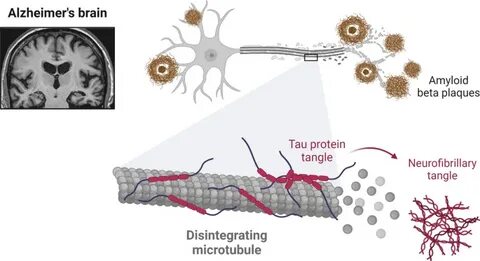
阿尔茨海默病(Alzheimer's Disease, AD)作为一种全球范围内最为常见的神经退行性疾病,其特征性病理表现包括tau蛋白缠结和淀粉样β(Amyloid beta, Aβ)斑块的异常积累。长期以来,科学界普遍认为这些异常蛋白质沉积最终导致神经元功能障碍和大脑结构损伤,进而引发认知障碍和记忆丧失。然而,最新的研究逐渐揭示,阿尔茨海默病的发病机制或许不仅仅是蛋白质沉积的简单结果,而与脑内复杂的废物清除系统密切相关。特别是胼胝体细胞(tanycytes)在疾病进程中的角色日益受到关注,成为探索疾病本质的一个重要方向。 胼胝体细胞是一类表达水通道蛋白Aquaporin-4(AQP4)的特殊胶质细胞,主要分布于脑室壁和下丘脑区域。传统观点中,胼胝体细胞被认为参与脑脊液与脑组织间的物质交换,调节神经激素的分泌及传递。
但最新的研究提出,这些细胞可能形成一个独特的水通道网络,专门负责脑内废物的内化和转运,这一过程对脑组织的代谢废物清除至关重要。研究表明,胼胝体细胞形成了被称为“肿胀体”(swell-bodies)的特殊结构,这些结构高度表达AQP4以及与废物内化相关的分子,同时具有捕捉和包裹废物颗粒的能力。更为重要的是,tau蛋白和Aβ蛋白在这些肿胀体中均有丰富的免疫反应性,提示它们可能不仅仅是病理产物,更具备调节和稳定废物通道结构的功能。 Aβ蛋白长期以来被认为是脑内异常沉积形成斑块的主要成分,这种斑块被认为会刺激神经周围的炎症反应,导致细胞损伤和死亡。新研究显示,Aβ可能具备一定的结构稳定作用,它通过参与胼胝体细胞肿胀体的构建,维持这些废物内化结构的完整性,防止其在废物吸附过程中塌陷。换言之,Aβ蛋白不只是致病因子,更有可能是胼胝体细胞介导废物清除机制的重要组成部分。
与此同时,tau蛋白则被推测在调控废物回收释放和细胞功能维护中扮演关键角色。正确数量和形式的tau蛋白有助于胼胝体细胞肿胀体的正常分化和功能实现,而tau蛋白异常磷酸化聚集为神经纤维缠结,则可能反映了胼胝体细胞系统在废物处理上的功能失调。 这些发现为理解阿尔茨海默病的发病机制带来了全新的视角。阿尔茨海默病引起的Aβ斑块和tau蛋白缠结,或许是胼胝体细胞介导的废物内化系统发生病理性肥大和结构异常的表现。换句话说,传统意义上被认为是病理产物的蛋白质沉积,实际上可能是脑内废物清除系统异常运作的结果。这种理论架构既解释了蛋白质沉积的局部性与特异性,也为未来治疗策略提供了新的切入点。
针对胼胝体细胞及其表达的AQP4通道的研究有望推动阿尔茨海默病的早期诊断和精准治疗方向发展。通过增强胼胝体细胞废物清除功能,恢复AQP4通道的正常表达,有望减缓甚至逆转蛋白质沉积过程,改善认知功能。此外,tau蛋白的调控与修饰也成为治疗研究的热点,旨在防止其异常聚集并恢复胼胝体细胞的正常废物调控功能。 阿尔茨海默病的复杂性使得单一治疗难以奏效,综合关注脑内废物清除系统与胶质细胞功能,将为研究者提供更全面的理解框架和治疗靶点。胼胝体细胞作为连接神经元与脑脊液的关键节点,其功能状态直接影响到脑内环境的稳态维持。未来的研究还需要深入揭示胼胝体细胞与其他胶质细胞以及神经元间的交互机制,探讨如何协同调节脑内蛋白质代谢和废物清除,实现阿尔茨海默病的综合防治。
总体上,胼胝体细胞在阿尔茨海默病中扮演的角色不断被揭示。AQP4表达的废物内化机制显示,tau蛋白缠结和Aβ斑块的形成不仅是疾病的标志,更可能是脑内废物处理系统功能障碍的直接表现。理解和干预这一过程,将极大推动阿尔茨海默病诊疗的变革,带来治疗效果的根本改善。随着科学研究的不断深入,未来基础神经科学与临床应用之间的桥梁将逐步建立,为全球数以千万计的患者带来福音。