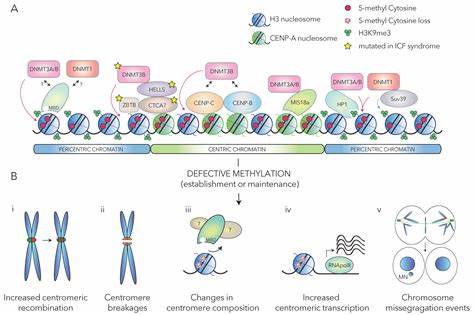
着丝粒作为染色体上的关键结构,承担着确保细胞分裂过程中染色体准确分配的使命。其定位和功能的维持对于基因组稳定性至关重要。近年来,研究发现表观遗传修饰,特别是DNA甲基化,在着丝粒的定位和功能调控中发挥着核心作用。DNA甲基化不仅影响染色质结构和基因表达,还在维护着丝粒的特异性区域和驱动其蛋白质组装过程中起到决定性影响。社会上对基因组完整性和疾病发生机制的关注,促使科学家不断探索DNA甲基化如何塑造着丝粒的精准位置及其在细胞周期中的作用。 着丝粒的基本生物学背景决定其成为复杂的多层调控系统。
人类着丝粒主要由高度重复的α-卫星DNA组成,这些171碱基对的重复单元排列成更为复杂的高阶重复序列,跨度可达数百万碱基对。着丝粒功能的核心标志是一种特殊的组蛋白变体CENP-A,它能够取代常规组蛋白H3,形成独特的染色质域。这些CENP-A富集区被称为活跃的高阶重复数组,定义了着丝粒的位置。然而,研究人员长期以来尚未完全理解是什么机制精准确定了CENP-A的装载位置及其边界。 DNA甲基化是涉及胞嘧啶核苷酸的5位碳原子添加甲基的典型表观遗传修饰。它在调控基因转录、染色质构象、DNA复制及修复等方面拥有广泛的功能。
人类着丝粒区域整体呈现高度甲基化,唯有在所谓的着丝粒浸低甲基化区域(centromere dip region, CDR)中出现相对缺失的DNA甲基标记。CDR与CENP-A密度最高的区段重合,似乎形成了一个界定着丝粒组蛋白装载的表观遗传边界。科学家通过开发精准的DNA甲基化编辑工具,例如结合十-十一转化酶1(TET1)催化域与CENP-B DNA结合域的构建体,实现了特定靶向着丝粒的主动DNA去甲基化操作。实验中,调控表达该融合蛋白,诱导着丝粒区域内的DNA甲基水平逐步下降,随即引发其蛋白质景观和功能状态的显著变化。 这类工具的使用揭示,着丝粒上的DNA去甲基化诱导了CENP-A和CENP-B蛋白结合量的增加,且CENP-A不仅在原有CDR区积聚,还可向其边界以外扩展。这一发现证实DNA甲基化作为边界信号参与界定CENP-A装配区的角色,其缺失打破了原有的限制,促使着丝粒的组蛋白排列结构发生了重塑。
此外,DNA去甲基化带来了着丝粒区域的染色质开放度提升,表明甲基化影响着丝粒的染色质密度和整体结构形态。 DNA甲基化状态还显著调节CENP-B与其结合位点 - CENP-B盒 - 的亲和力。体外实验表明,未甲基化的CENP-B盒对CENP-B的结合力远强于甲基化后的状态,说明甲基化通过阻碍CENP-B与DNA的结合,限制了CENP-B在着丝粒上的过度积累。实验中观察到,着丝粒DNA去甲基化造成CENP-B过度积累,随之产生的染色体分离异常现象和细胞增殖受损,突显了DNA甲基化的调控作用对于维系染色体稳定性和细胞存活的必要性。 细胞在快速诱导的DNA去甲基化过程后出现广泛的染色体错配和非整倍体,表现为微核增多和染色体断裂,这些病理性事件多发生在着丝粒邻近的区域。该现象揭示出DNA甲基化的缺失直接影响着丝粒的机械功能,使染色体在有丝分裂时无法精准分离,导致基因组不稳定,进而可能诱发细胞凋亡或肿瘤发生风险。
更进一步,超分辨率显微技术显示,去甲基化改变了着丝粒结构的分布,导致CENP-A亚域分布异常,破坏正常的双分级着丝粒结构,这一结构对正确的动粒-微管相互作用至关重要。 有趣的是,缓慢且渐进的DNA去甲基化过程则不同,细胞可借助某种适应机制调整其着丝粒蛋白的水平及分布,维持相对稳态。这种适应性为免疫缺陷、着丝粒不稳定及面部异常综合征(ICF)患者细胞提供了某种生存基础,尽管他们的着丝粒甲基化水平降低。相关细胞模型显示,逐步剥夺DNA甲基后,细胞在经历早期不稳定后能逐渐稳定染色体功能,尽管CENP-A和CENP-B的表达持续升高,这种演变反映出表观遗传调控的动态可塑性。 从机制角度考虑,DNA甲基化与着丝粒功能间存在反馈调控。CENP-A的装载可能促进局部DNA的低甲基化状态,反之甲基化限制CENP-A的沉积。
甲基化影响组蛋白的修饰及染色质构象,间接调控着丝粒蛋白的组装。此外,DNA甲基化阻断的CENP-B结合限制了DNA环路的形成,防止过度机械张力与复制压力产生染色体断裂。该发现改写了过去关于DNA甲基化仅作为沉默标记的认识,强调了其在染色体结构的精细空间定位中的积极调节功能。 临床相关方面,研究证实某些癌症类型中着丝粒区域的DNA甲基化显著下降,这种改变增强了基因组的不稳定性,促进肿瘤的发生与进展。揭示DNA甲基化对着丝粒的保护作用,指明疾病防治中新兴的靶向表观遗传调控策略。通过调整DNA甲基化,或调控相应维持酶如DNMT1与DNMT3B的活性,未来或许可减缓染色体错配,降低肿瘤细胞的染色体畸变。
综合现有研究,DNA甲基化作为人类着丝粒的关键信号,调节CENP-A的定位、着丝粒的结构完整性以及染色体的正确分离。去甲基化扰动引发的蛋白质组装异常和结构紊乱造成细胞分裂缺陷和基因组不稳定,最终影响细胞的存活率。与此同时,细胞具备一定的适应与补偿能力,应对渐进性甲基化变化。未来的研究需要进一步揭示DNA甲基化与其他组蛋白修饰和染色质构象的综合作用机制,并探索其在遗传疾病和癌症中的诊断及治疗潜力。 从广义上看,DNA甲基化在调控人类基因组稳定性方面扮演着多层次、多面向的角色。着丝粒作为基因组结构的基础单元,其功能的准确执行依赖于甲基化状态的精细调节,这一发现丰富了我们对于表观遗传与染色质功能关系的认识。
了解DNA甲基化如何影响着丝粒,不仅有助于解释细胞在分裂过程中如何避免基因组不稳定,还为未来生物医药领域提供了新的研究思路和潜在治疗靶点。 。