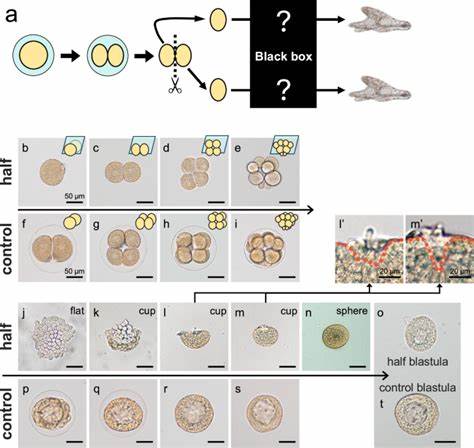
海胆作为海洋生物中研究胚胎发育的重要模式生物,其在理解调节性发育和分子自我组织机制方面具有独特优势。早在19世纪末,科学家横井德雷施(Hans Driesch)通过海胆胚胎的经典实验发现,早期分裂的细胞即使被分离,也能独立发育成为完整个体,这一现象揭示了早期胚胎具有惊人的调节性发育能力。近年来,随着分子生物学技术的发展,科学家重新关注海胆同卵双胞胎的自我组织过程,进一步解析其发育形态变化和体轴重塑的分子基础,对解明胚胎早期发育的稳健性和可塑性提供了新的视角。 在典型的海胆胚胎发展中,受精卵经历一系列规律的细胞分裂,形成明确的动物极和植物极,进而确立前后轴(A-P轴)和背腹轴(D-V轴)。然而,当胚胎在二细胞阶段被人为分割,形成两独立的胚泡时,这些分离的胚泡并不会像正常胚胎那样直接形成球形胚胎,而是经历一个独特的形态变化过程。最初,分离的每一半呈现为扁平状的单层细胞结构,随后边缘逐渐上翘呈杯状,最终闭合成球形胚泡。
这种"扁平 - 杯状 - 球形"的转变过程,体现了海胆早期胚胎细胞的高度调节与重组能力。 细胞形态的改变不仅仅依赖于细胞数量的增加,而是细胞自身的形态变化和内在力学驱动。其中,细胞沿顶端 - 基底轴(apical-basal axis)的显著拉伸是特有现象。先进的活细胞成像技术显示,在形态转变阶段,细胞基底侧的肌动蛋白(actin)及其相关肌球蛋白(myosin)聚集尤为显著,这种基底侧的肌动蛋白-肌球蛋白活性产生的内在张力驱动细胞伸长,使细胞呈锥形排列。利用肌动蛋白聚合抑制剂环胞酰苷D和肌球蛋白活性抑制剂Blebbistatin的实验进一步证实,肌动蛋白运动对于扁平结构向球形的转变至关重要,阻断这一步骤则阻碍形态重组。 除了细胞自身的骨架动力学,细胞间的紧密连接也参与了这一形态形成过程。
海胆胚胎中存在类似无脊椎动物特有的密闭连接类型 - - 间隙连接(septate junctions),这些连接在细胞边界形成稳固的黏附结构,促使切分的细胞群保持协同和紧凑。研究显示,间隙连接相关基因如四跨蛋白(Tetraspanin)和蛋白ZO-1在形态转变期高度表达,且它们的功能缺失会导致细胞排列混乱,形态转变不完全。该事实强调了细胞-细胞黏附机制在胚胎复原与组织重塑中的关键作用。可以说,细胞的内在驱动力和细胞间的机械黏附共同塑造了海胆分割胚胎独特的自我组织路径。 随着形态从平坦向球形过渡,体轴特别是前后轴(A-P轴)经历了暂时的紊乱。原本海胆胚胎早期已明确的前端标记基因FOXQ2和后端标记基因FOXA的表达在球形形成初期相互靠近,体现了轴向信息的短暂紊乱。
然而,随后胚胎通过重新利用Wnt/β-联蛋白信号通路逐步重建正常的轴向模式。実时活体成像揭示,在球形阶段,β-联蛋白一度在原后极附近核内聚集,激活后方信号区域,诱导前端表达基因发生空间转移,从而完成轴向的重组和极性的恢复。阻断Wnt/β-联蛋白信号会阻碍轴向的重建,表明该信号通路在胚胎自我组织和调节性发育中的核心地位。 除了前后轴的恢复,背腹轴(D-V轴)的形成也显示出与全胚胎不同的动态。"扁平 - 杯状 - 球形"阶段中,背腹轴相关基因如Nodal及其抑制因子Lefty的表达模式暂时呈现扰乱,表现为广泛或不规则表达,直至球形胚胎进一步发育后才重新定位至正常区域。磷酸化Smad蛋白的检测则提示TGF-β信号通路在背腹轴重组过程中也发挥了重要作用。
这一发现说明轴向发育的重塑是一个多信号通路相互协调调控的复杂过程,而非单一信号的线性输出。 上述研究成果进一步扩展了我们对胚胎自我组织能力的理解,阐明了早期胚胎在遭遇重大结构损伤或分割时,并非通过基因去分化或重编程,而是依靠残存细胞的内在极性、自主形态调整及限域信号重新分布实现调节性发育。对海胆同卵双胞胎而言,细胞间通过间隙连接实现精密机械协作,而肌动蛋白-肌球蛋白的动力学调节则提供形态塑造的动力,二者共同促进了完整个体的再生可能。与此同时,信号通路如Wnt/β-联蛋白和Nodal等修复错乱的体轴信息,确保胚胎的正确分化与功能生成。这种双层结构与功能的协调方案,不仅体现了发育生物学的精妙,也为再生医学和组织工程提供了宝贵的生物学借鉴。 从进化角度来看,海胆胚胎的调节性发育能力表明,动物早期胚胎在面对环境不确定性和损害时,具备强大的韧性和恢复潜能。
这种机制的存在可能是物种适应性演化的重要基石,确保基因组稳定传递和形态完整。与两栖类青蛙等其他模式生物类似,海胆等棘皮动物通过空间-时间上的信号再利用,实现胚胎体轴及形态的高度塑性和调节,体现了发育程序的保守性和多样性共存。 未来的研究可以进一步探讨海胆胚胎调节发育中细胞力学和生物电信号的作用,解析其他可能参与细胞间通讯的分子组件。此外,探索不同海胆物种间调节发育的差异,为阐明进化驱动力提供材料。利用基因编辑和单细胞组学技术,有望揭示更细致的细胞命运转变和分子调控网络,助力破解发育生物学的终极秘密。 整体而言,海胆同卵双胞胎的调节性发育研究让我们深入了解了早期胚胎如何通过细胞自我调控、信号路径再编程及形态塑造机制,实现个体完整性和体轴重建,为开发新型生物医学治疗手段和组织再生策略奠定坚实基础。
。