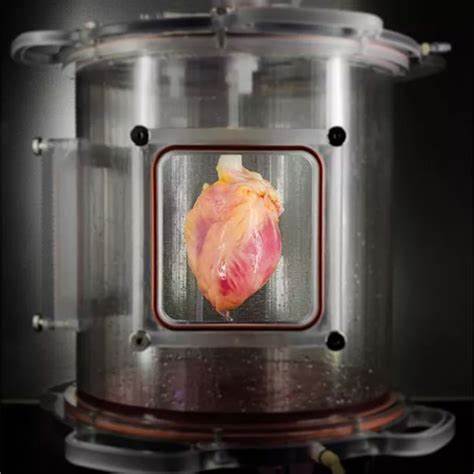
近年来,生命科学领域不断涌现出令人瞩目的技术突破,尤其是在类器官(organoids)技术方面取得了显著进展。类器官是由干细胞或祖细胞在实验室微环境中自行组装形成的三维细胞团块,能够模拟人体内部器官的结构和功能。最近,科学家们成功地培育出迷你心脏、肺和肝脏类器官,并使其具备了自主生长血管的能力,这一重要突破不仅极大地提升了类器官的复杂性与生理相关性,也为未来的疾病研究和临床应用带来了全新契机。 传统上,类器官模型受限于缺乏血管系统无法有效维持较大组织块的氧气和营养供应,限制了其体积和功能的扩展。血管作为维持器官生命活动的关键网络,不仅负责物质运输,也参与器官的发育和修复,尤其在人类器官发育过程中起着不可替代的作用。通过最新的研究技术,科研人员通过调节干细胞的微环境和基因表达,实现了类器官内部血管网络的自发生成,这让类器官的结构更接近真实器官,使得研究者能够更深入地观察器官形成与疾病发展过程。
迷你心脏类器官的发展目的在于模拟人类心脏的结构和电生理功能,这对于心血管疾病的病理机制探究、药物筛选和个性化治疗方案制定具有极大意义。通过引入血管生成的关键因子,迷你心脏类器官不仅展现出更稳定的收缩力和节律,还能更真实地反映血液循环对心肌细胞影响。研究显示,带有自主血管系统的迷你心脏类器官在药物反应测试中的表现更符合人体真实反应,有助于降低动物实验的使用,提高新药临床转化率。 同样具备血管生成能力的迷你肺类器官,为呼吸系统疾病研究打开了新篇章。肺部作为气体交换的关键器官,其内复杂的血管网络对氧气运输至关重要。带有血管系统的迷你肺类器官能够更准确地模拟呼吸过程中气体与血液的交换机制,提升对肺部感染、慢性阻塞性肺病以及肺纤维化等疾病机制的理解。
同时,这些模型为测试吸入药物的安全性和疗效提供了更合理的平台。 肝脏作为人体最大的解毒器官,拥有丰富的血管系统支持其多样化的代谢功能。传统肝脏类器官模型因血管缺失导致代谢功能和细胞存活能力较弱。现在,科学家在肝脏类器官中成功引入了毛细血管样结构,使其具有更高的代谢活性和更长的存活时间。这对肝脏疾病研究,尤其是肝炎、肝纤维化以及肝癌的药物筛选具有深远影响。此外,这些具备血管网的肝类器官有望成为肝移植的替代选择,缓解器官供体短缺的问题。
这些重大进展背后,离不开多学科技术的融合。干细胞生物学、基因编辑技术、3D生物打印以及微流控芯片技术的结合,为构建血管网络提供了关键支持。微流控技术模拟血液流动环境,促进血管内皮细胞形成,3D打印则帮助精确构建血管空间结构。通过对细胞微环境的精确调控,科研人员能够引导干细胞分化并协调多种细胞类型的相互作用,确保类器官内部血管系统的正常构建与功能实现。 除了基础科学研究,这些血管化类器官模型将对制药产业产生深远影响。现有的药物研发流程成本高昂且周期漫长,许多药物因在临床阶段表现出毒性或低效未能通过审批。
基于血管化类器官的精准模型能够更真实地反映人体组织对药物的反应,优化药物筛选过程,提高新药研发的成功率,同时减少动物实验的依赖,推动更为伦理的科学研究。 展望未来,带有自主血管系统的类器官技术有望与免疫系统模型结合,构建更加接近人体微环境的三维模拟体系。这将为病毒感染、自身免疫性疾病以及器官移植耐受性研究提供全新工具。此外,患者来源的个性化类器官模型能够用于精准医疗,帮助医生制定更有效的治疗方案,实现真正的个体化治疗。 然而,这项技术依然面临诸多挑战。血管网络的复杂程度与真实器官相比仍有差距,如何实现多细胞类型的精准定位和功能协调,维持长时间的血液循环模拟,仍需进一步研究。
此外,如何大规模生产这些高复杂度的器官模型,并建立标准化的质量控制体系,也是未来需要解决的问题。 总的来说,实验室培育的能够自主生成血管的迷你心脏、肺和肝脏类器官,代表了生命科学研究迈向高度仿真人体器官模型的重要里程碑。它不仅为解答人类发育、疾病机制提供了先进的平台,也为新药研发和再生医学开辟了广阔前景。随着技术不断成熟,未来这些类器官有望成为临床治疗的重要辅助工具,助力人类攻克更多疾病难题,推动医疗健康水平进入全新时代。