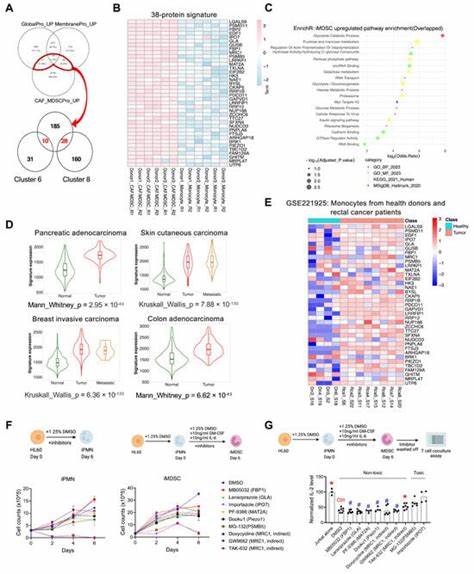
脑部神经退行性疾病如阿尔茨海默病、帕金森病、运动神经元病(ALS)和额颞叶痴呆等,长期以来一直是医学领域的重大挑战。早期症状的模糊及彼此间的相似性,加大了临床诊断的难度,使得患者无法在病情初期接受针对性的治疗。近年来,随着蛋白质组学技术的进步,研究人员开始关注血液与脑脊液中蛋白质组成的变化,期待通过“蛋白质签名”这一独特的生物标记物,精准区分不同脑部疾病,甚至在症状出现之前就提前发现疾病风险。 蛋白质是细胞功能的执行者,维持生命活动的正常运行。神经疾病的发病机制往往与蛋白质折叠异常或功能失调息息相关。基于此,全球神经退行性蛋白质组学联盟(GNPC)于2023年成立,通过整合来自美国和欧洲20多个不同队列的逾18,000名患者血液与脑脊液样本,展开了规模空前的关联研究。
研究团队运用高灵敏度的蛋白质检测和分析方法,绘制出了覆盖多种脑部疾病的蛋白质生物指纹图谱。 这项研究揭示了多种脑病的独特以及交叉的蛋白质签名。例如,携带阿尔茨海默病最强遗传风险基因APOE4变异的个体,在其血液中显示出一套与免疫反应和炎症相关的蛋白质特征,这一签名不仅出现在已经诊断为阿尔茨海默病的患者身上,也反映在帕金森病等其他脑疾病患者乃至无神经退行状况的携带者中。此发现表明APOE4可能通过引发全身和脑部的免疫炎症反应,在疾病的早期阶段便开始影响神经系统。此外,研究者利用类脑器官模型验证了含APOE4基因的细胞就会在特征性蛋白质(如tau蛋白和β淀粉样蛋白)积累之前表现出炎症迹象,进一步表明炎症在疾病发病路径中的关键地位。 对不同神经疾病而言,蛋白质签名同样展现出明显差异。
研究发现,相较于阿尔茨海默病患者,帕金森病患者的器官老化模式呈现出完全不同的特征;而额颞叶痴呆和ALS在蛋白质表达的变化上也显示出独特性。这说明不仅疾病本身存在生物学差异,且影响疾病发生的途径和机制多样,为未来的精准医疗提供了坚实基础。 这些蛋白质生物指纹不仅具备早期诊断价值,还能够帮助划分疾病亚型。早期识别不同亚型,对于制定个性化治疗方案、监测疾病进展至关重要。传统的影像学和临床表现往往难以做到这一点,而基于蛋白质组学的检测则有望弥补这一不足,推动神经科领域的诊断手段实现质的飞跃。 目前,美国食品药品监督管理局(FDA)已经批准了用于阿尔茨海默病的血液诊断测试,但由于检测过程复杂、需要使用放射性材料和同步辐射装置,实际应用受到很大限制。
相比之下,蛋白质组学检测依托普通的血液与脑脊液样本,且检测技术不断成熟和普及,有望在未来几年内实现对多种神经退行性疾病的广泛筛查。 蛋白质特征的发现不仅对诊断具有意义,还为治疗手段的开发提供了新方向。炎症过程在APOE4相关路径中的影响提示了抗炎治疗的潜力。已有研究显示带状疱疹疫苗能够降低痴呆发病风险,这可能得益于对炎症反应的控制。未来,针对蛋白质异常表现的治疗策略,如调节免疫反应、阻断异常蛋白质聚集等,有望成为神经退行疾病的重要干预手段。 此外,全球神经退行性蛋白质组学联盟的研究成果,为科学家开放了一个规模庞大、一致性强的数据库。
研究者们可以基于这些真实患者样本数据直接提炼出疾病机制和潜在药物靶点,无需依赖传统的动物模型,极大提升了研究效率与转化应用速度。随着项目进入第二阶段,将依次纳入来自南美、南亚、非洲和大洋洲的患者样本,这不仅丰富了数据多样性,也为不同族群的疾病特征研究奠定基础,推动脑部疾病研究迈向全球化和精准化。 展望未来,基于蛋白质签名的检测技术有望成为脑部疾病筛查和监测的常规手段,为早期识别和分类诊断提供便利。患者无需经历复杂昂贵的影像学检查,只需抽取普通血样,即可获得详尽的疾病风险分析和亚型判别。这不仅促进了个性化医疗的发展,也助力医疗资源的合理分配和使用。 总之,蛋白质签名的研究成果正逐步揭示出神经退行性疾病复杂且深刻的生物学内涵。
透过这些分子密码,科学家们正开启一种全新的诊断与治疗模式,为数以百万计的患者带来更多希望。随着技术日趋完善和全球合作不断加强,未来人体内的微妙蛋白质变化或将成为揭示脑健康命运的关键钥匙,推动医学迈入全新的时代。